发布时间:2024-05-28 浏览量:0

CAR-T细胞疗法是一种特殊的免疫疗法,通过遗传修饰患者自身的T细胞,给T细胞安装一个瞄准镜,经过修饰的CAR-T细胞体外增殖后再输注回患者体内,形成一支杀伤性的细胞部队,能够特异性地攻击肿瘤细胞。
虽然CAR - T细胞在治疗B细胞恶性肿瘤中已显示出成功的临床应用,但严重不良事件的发生是CAR - T细胞治疗的一个重要限制,其中最受关注的不良反应为细胞因子释放综合征(cytokine release syndrome,CRS)。CRS是指在免疫细胞和肿瘤细胞作用的过程中,大量释放细胞因子,这些细胞因子又会引发进一步的连锁反应。细胞因子释放综合征的轻度临床表现为发热、疲劳、头痛、关节痛、肌痛,严重者以低血压、高热为特征,进一步加重可引起休克、血管渗漏、弥散性血管内凝血和多器官功能障碍综合征,最终危及生命。
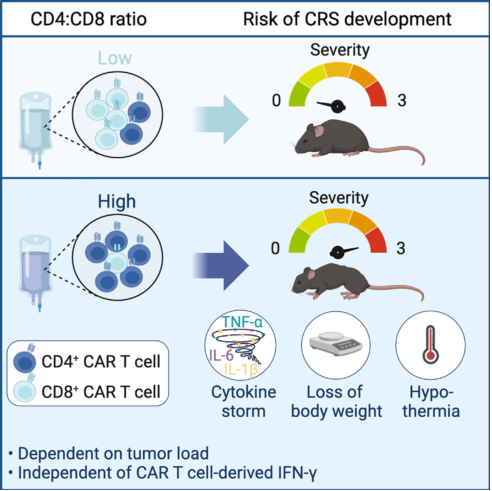
那么是什么导致的CRS呢?研究表明,CD4+ CAR -T和CD8+ CAR -T细胞的比例是CRS相关的一项重要指标,然而,目前尚不十分清楚CD4+ CAR T细胞和CD8+ CAR T细胞对于引起CRS产生的作用是否相同。近期,来自巴斯德研究所的Philippe Bousso团队通过研究发现, CRS的发生是主要由CD4+ CAR-T细胞介导的,而且在肿瘤负荷越高的情况下,CD4+ CAR T细胞介导的CRS反应越严重。相关研究发表在Cell Reports Medicine上。

该团队使用免疫健全的小鼠构建了Eμ-myc B细胞淋巴瘤小鼠模型。将小鼠分为纯化的CD4+ CAR-T 治疗组、纯化的CD8+ CAR-T治疗组和未治疗组。结果显示CD4+ CAR-T的输注产生了明显的毒性,治疗第3天体温急剧降低,体重下降,血清细胞因子和趋化因子普遍升高(图3)。而且地塞米松和anti-IL-6的干预可以减轻体重的降低(图4),这是临床治疗CRS的有效措施。而CD8+ CAR T的毒性表现则与对照组差别不大。说明CAR-T输注后的毒性反应主要是由CD4+T细胞引起的,而不是CD8+T。
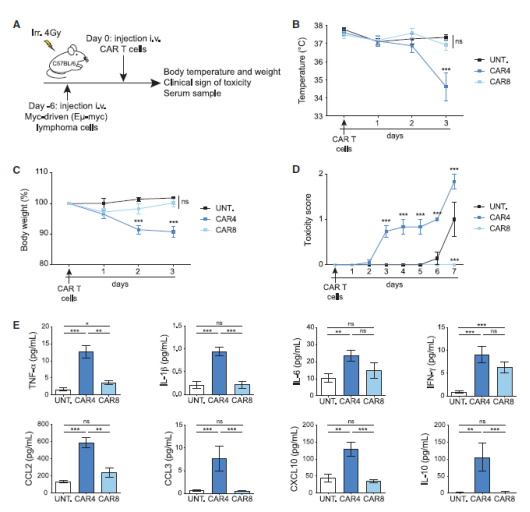
图3. CD4+CAR-T和CD8+CAR-T输注后,小鼠体征和血清细胞因子及趋化因子的变化
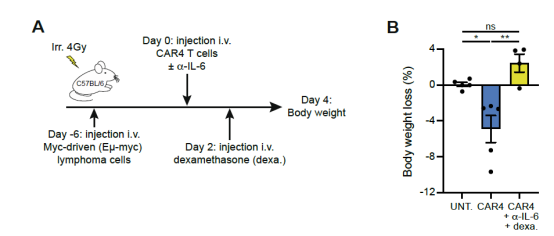
图 4. 地塞米松和anti-IL-6的干预可以减轻CD4+CAR-T回输后导致的体重降低。
接着,他们进行了CD4/CD8固定比例混合细胞的输注。发现CD4/CD8比例为9:1时输注也产生了与CD4+ CAR T相近的毒性,而CD4/CD8为1:1时则与阴性对照无差异(图5)。说明CRS的发生不止局限于CD4+CAR-T,还发生在CD4+CAR-T占较高比例的混合CAR-T细胞中。
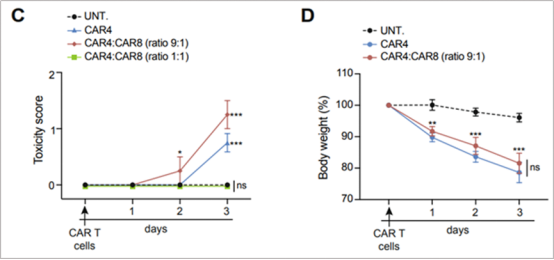
图 5. 输注混合CAR-T细胞CD4/CD8比例为9:1时产生更高的毒性。
为了验证CAR-T细胞 与CRS等级的相关性,作者分析了76名接受CD19CAR-T治疗的DLBCL患者血液中总CD3+CAR-T、CD4+ CAR T和CD8+ CAR T的细胞绝对数量。与未发生CRS的患者相比,发生1~3级CRS的患者,在回输后第7天的峰值前后,其外周血中total CD3+ CAR T、CD4+ CAR T和CD8+ CAR T细胞的绝对数都更高。但CD4+ CAR -T细胞的增加更为明显(图6)。经历CRS(1级、2级或3级)的患者比没有经历CRS(0级)的患者血液中CD4+ CAR - T细胞平均多3.43倍,而CD8+ CAR - T细胞平均多1.73倍。总之,这些临床观察结果与CD4+ CAR - T细胞在CRS诱导中起主要作用的观点一致。
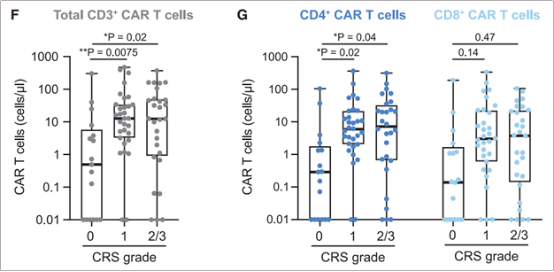
图6. 患者CAR-T回输后第7天的峰值前后,外周血中total CD3+ CAR T、CD4+ CAR T和CD8+ CAR T细胞数。
另外,作者还发现在与未经治疗的小鼠相比,在高肿瘤负荷的情况下进行CD4+CAR-T细胞治疗更容易引发CRS,包括体温下降、体重减轻、疾病评分高和过早死亡(图7) ,低肿瘤负荷的CAR4 T细胞治疗没有引发可检测到的毒性。这也暗示CD4+CAR-T细胞占优势加上高肿瘤负荷更容易导致CRS的发生。
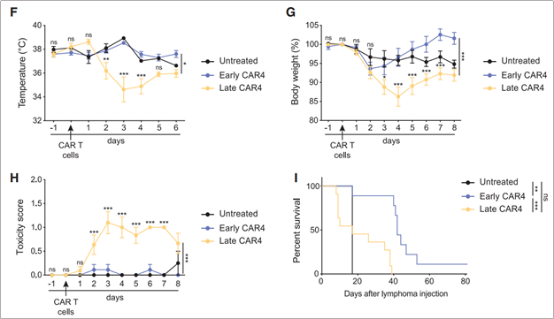
图7. 在高肿瘤负荷的情况下进行CD4+CAR-T细胞治疗更容易引发CRS
因此,针对患者的肿瘤负荷调整CD4:CD8 CAR - T细胞比例,为患者提供更加个性化的治疗方案,可能更有助于减轻CAR - T细胞相关的毒性。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


