发布时间:2024-04-16 浏览量:0

骨缺损是目前骨科一种严重的难治性疾病,临床上骨缺损主要由严重的创伤、感染、肿瘤切除、先天性畸形等引起。
现有骨缺损的治疗方法
PART 01
自体骨移植是治疗骨缺损的常规治疗方法,但这种治疗方法可能引起慢性疼痛、血肿、感染、血管神经损伤等并发症,限制了临床应用;同种异体骨移植是治疗骨缺损的另一种选择[1],但受到免疫排斥和疾病传播风险的限制。
人工骨不受移植骨并发症的影响,可以通过注射硫酸钙/磷酸钙材料 [2]或β-磷酸三钙(β-TCP)[3],用于维持解剖结构和促进功能恢复。然而,在骨缺损修复过程中,人工骨不太可能实现完全的骨再生。因此,目前用作人工骨材料的生物陶瓷的长期有效性取决于改善骨传导、骨诱导和成骨的条件。
间充质干细胞(Marrow mesenchymal stem cells, MSCs)具有很强的成骨分化潜能[4],用作骨填充材料可促进成骨[5]。β-磷酸三钙(β-TCP)具有良好的生物和组织学特性:
①骨诱导性:磷酸钙生物陶瓷具有良好的生物相容性,作为人工骨材料,骨修复作用主要体现在骨传导性方面,可以为新骨的形成提供支架;
②降解性:磷酸钙生物陶瓷的多孔结构使接触面积增大,加速了在体内的降解过程。
因此,MSC/β-TCP复合材料有可能是一种有前景的、在临床可行的骨缺损修复材料。
MSC/β-TCP复合材料如何发挥作用?
PART 02
首先,MSC/β-TCP复合材料可作为骨形成的支架。MSC/β-TCP复合材料既具有成骨性,又具有骨传导性,有利于新骨的形成。MSC附着在β-TCP支架的内表面,从而使支架的表面和中心能够成骨。与单独使用MSC,骨髓或β-TCP相比,该复合支架可以诱导更多的骨小梁和新的骨量,具有更高的局部融合率和稳定性[6]。
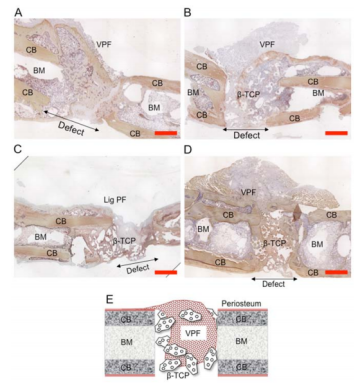
图 | 大鼠股骨缺损的组织学切片[7]
其次,β-TCP负载MSC可以发挥其旁分泌的作用。已有研究表明,骨缺损的大小可能限制骨形成细胞的向内生长,并且血管的缺乏不能为骨移植物提供足够的营养支持。骨缺损中支架的早期血管化可能是成骨修复细胞长入体内以实现骨再生所必需的。而在β-TCP支架上植入MSC或EPC在体内可以观察到VEGF分泌。与未植入细胞或细胞/β-TCP复合材料的骨缺损相比,植入EPC、MSC或两种细胞组合的细胞/β-TCP复合材料的骨缺损中VEGF含量更为丰富[8]。因此,细胞/β-TCP复合材料的应用改善了骨缺损处的血管化进而加速骨愈合。

图 | VEGF分泌[9]
未来展望
PART 03
据不完全统计,全球每年都要进行约200万例骨移植。
然而,庞大的需求背后,这种从其他部位“挪用”骨骼的疗法却并不完美,存在着可用性低,再生能力较低,免疫排斥等问题。
因此,医学上迫切需要治疗难以愈合的骨折和大尺寸骨缺损的新方法。MSC/β-TCP复合材料是第一个基于生物材料的异位骨形成模型,揭示这一途径的细胞和分子机制,让我们再次看到了干细胞以及再生医学的潜力,为骨修复的临床应用提供了一种新的途径。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


