发布时间:2023-11-17 浏览量:0
皮肤是人体最大的器官,也是人体第一道屏障,时刻都有着被损伤的风险。干细胞因其免疫原性小、取材丰富等优势也成为了皮肤病方向研究者们关注的焦点。
此前,一篇发表在《Indian journal of dermatology》上的综述展示了干细胞疗法在皮肤病学上的研究现状[1],认为干细胞疗法的出现为当前无法治愈的疾病提供了新的思路,并且展示了干细胞在系统性硬化症、系统性红斑狼疮、银屑病、伤口愈合、医美等与皮肤病学相关的多个领域的应用前景。

干细胞是存在于不同器官组织中的未分化细胞,具有自我更新、分化和可塑性三大特征。在皮肤中,干细胞存在于毛囊间表皮、毛囊、真皮和脂肪组织中,有助于维持正常皮肤的动态平衡和损伤时的修复和再生。也正是基于其独特的特性,它已被用于多种皮肤相关的临床研究中。
干细胞与美容医学方向
2021年《中国美容整形外科杂志》刊发了《干细胞在整形修复美容领域研究和临床试验的专家共识》,目的是沟通和提高我国整形修复美容领域从事干细胞基础和临床研究工作者的认知,以更好的推动干细胞的临床转化应用研究。

该共识探索干细胞在整形修复美容领域的系统化、科学化、规范化和标准化,以及安全有效应用路径的共识,已具备扎实的科学理论和实践基础。并且该共识中也强调了干细胞衍生物的应用:干细胞分泌的生长因子通过在老化的皮肤中补充生长因子,可提高皮肤通过各种活性因子促进真皮层内纤维母细胞的增殖能力, 修复老化的胶原纤维与弹性纤维,还原肌肤弹性并减少皱纹。
研究发现,脂肪源性干细胞可以激活成纤维细胞,分泌多种生长因子,从而使皮肤产生色素一定程度减轻和伤口愈合的作用。成纤维细胞在创面愈合中和修复受损真皮成分中起着至关重要的作用,培养的自体成纤维细胞在美容医学方面有着广阔的应用前景[9]。
干细胞与银屑病
银屑病又称牛皮癣,是一种慢性复发性炎症性疾病,即使近年来银屑病发病机制的探索取得了相当大的进展,但是目前还没有完全令人满意的治疗方法。
2022年8月5日,我国一医院在Nature子刊《signal transduction and targeted therapy》发表间充质干细胞在银屑病反向的最新临床研究结果[3]。

该项临床研究证实了人脐带来源间充质干细胞在银屑病方向的临床应用研究中的有效性、安全性,并探讨了其可能的作用机制,为未来银屑病治疗开辟了崭新的医疗新技术,开拓了银屑病治疗新方向,代表着中国银屑病的干细胞临床研究领域新的突破[4]。
2022年7月发表的《间充质干细胞移植治疗银屑病研究进展》中提到几项临床试验结果:两次寻常型银屑病患者应用脐带间充质干细胞(UC-MSCs),皮损消失,且均保持四年或五年无复发。

大量研究证实干细胞参与了银屑病的发病机制,其功能障碍可能是银屑病炎症反应失调的根本原因,因此认为干细胞是银屑病的一种重要的潜在临床应用工具。在我们国家,已经有针对银屑病的间充质干细胞注射液临床试验申请获得受理。国际上也有多项干细胞在银屑病方向的临床研究正在开展当中。
干细胞系统性红斑狼疮
系统性红斑狼疮是一种自身免疫性疾病,可累及皮肤、浆膜、关节、肾及中枢神经系统等。2022年1月,《中华风湿病学杂志》发布了由国内风湿免疫学领域众多专家共同完成的《异体间充质干细胞治疗系统性红斑狼疮专家共识》。

多项临床研究已经证实,间充质干细胞治疗SLE患者安全有效。为了规范间充质干细胞的临床应用,专家组对间充质干细胞治疗SLE的适应证、用法、输注次数及细胞数、输注前用药及输注后合并用药以及在合并妊娠、感染和肿瘤等情况时的应用制定了推荐意见。
1997年发表了首例自体干细胞治疗系统性红斑狼疮成功的病例报告,随后进行了许多观察性研究和临床试验。
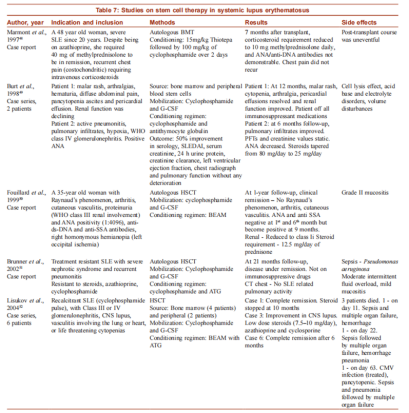
△干细胞治疗系统性红斑狼疮的研究[1]
在我国,南京大学鼓楼医院孙凌云教授团队的“异体间充质干细胞治疗难治性红斑狼疮的关键技术创新与临床应用研究”攻克了红斑狼疮治疗的世界性难题,现已推广应用到35家省内外单位。

干细胞与伤口愈合方向
间充质干细胞在伤口愈合的所有过程中都发挥重要作用,用间充质干细胞针对大面积皮肤烧伤,可使供区更快愈合,促进新血管生成,并通过可缩短患者住院时间,也有研究者发现间充质干细胞可用于烧伤后患者疤痕方向的应用中。
2022年一项临床研究中发现158名有急性伤口的患者接受间充质干细胞治疗后临床创面愈合率提高,治疗10天后肉芽组织覆盖率和肉芽组织厚度分别达到了32.6±10.1%和3.47±0.84 mm,创面出血及化脓性创面发生率也有一定程度的降低。
另外干细胞在糖尿病足方向的临床研究也有较好的表现,齐鲁细胞治疗与徐州医科大学附属医院、上海长海医院的关于间充质干细胞在糖尿病足方向的备案项目,后期完成后也会为大家做详细的介绍。
干细胞与系统性硬化症
系统性硬化症也被称为硬皮病,是累及全身的自身免疫性疾病,以局部性或弥漫性皮肤增厚和纤维化为特征。近年来,干细胞被应用到了系统性硬化症方向的研究当中。三项随机对照试验表明——美国硬皮病干细胞与免疫抑制试验、自体干细胞移植国际硬皮病试验、硬皮病环磷酰胺或移植研究,自体干细胞的临床应用是针对系统性硬化症的有效、安全和可行的方法。
多项研究也表明干细胞的应用与传统的免疫抑制疗法相比,是目前唯一一种改善长期生存、防止器官恶化、改善皮肤和肺功能以及改善患者整体生活质量的策略。
未来展望
现阶段,干细胞的临床应用研究已经在多种难治性病症中进行了尝试,并取得了一些成功。但是现阶段的探索中,仍有许多难点需要在未来解决,比如干细胞制剂如何标准化,如何进行大规模验证等等。
11月14日,科技日报发布文章《干细胞技术:快车道上还需系好标准“安全带”》,重点提到干细胞领域已经成为生物医药产业的热点,是生物技术中具有前瞻性的领域,而我国干细胞技术发展已步入快车道,同时对干细胞作为“万能细胞”的作用、我国干细胞研究和应用的规范化、标准化进行探讨。

干细胞临床应用的出现使得以前被认为无法治愈的疾病有了治愈的希望,也相信未来随着研究的完善以及深入,会为我们带来更多的可能。
【注】文章内容旨在科普细胞类知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。
参考文献
[1] Khandpur, S., Gupta, S., & Gunaabalaji, D. R. (2021). Stem cell therapy in dermatology. Indian journal of dermatology, venereology and leprology, 87(6), 753–767. https://doi.org/10.25259/IJDVL_19_20
[2] Vanikar, A. V., Trivedi, H. L., Patel, R. D., Kanodia, K. V., Modi, P. R., & Shah, V. R. (2012). Allogenic hematopoietic stem cell transplantation in pemphigus vulgaris: a single-center experience. Indian journal of dermatology, 57(1), 9–11. https://doi.org/10.4103/0019-5154.92667
[3] Owczarczyk-Saczonek, A., Krajewska-Włodarczyk, M., Kruszewska, A., Placek, W., Maksymowicz, W., & Wojtkiewicz, J. (2017). Stem Cells as Potential Candidates for Psoriasis Cell-Replacement Therapy. International journal of molecular sciences, 18(10), 2182. https://doi.org/10.3390/ijms18102182
[4] Chen, W., Ren, G., Zuo, K., & Huang, X. (2018). Complete remission of both immunoglobulin light chain amyloidosis and psoriasis after autologous hematopoietic stem cell transplantation: A case report. Medicine, 97(50), e13589. https://doi.org/10.1097/MD.0000000000013589
[5] Kaffenberger, B. H., Wong, H. K., Jarjour, W., & Andritsos, L. A. (2013). Remission of psoriasis after allogeneic, but not autologous, hematopoietic stem-cell transplantation. Journal of the American Academy of Dermatology, 68(3), 489–492. https://doi.org/10.1016/j.jaad.2012.08.021
[6] Otero-Viñas, M., & Falanga, V. (2016). Mesenchymal Stem Cells in Chronic Wounds: The Spectrum from Basic to Advanced Therapy. Advances in wound care, 5(4), 149–163. https://doi.org/10.1089/wound.2015.0627
[7] Anderi, R., Makdissy, N., Azar, A., Rizk, F., & Hamade, A. (2018). Cellular therapy with human autologous adipose-derived adult cells of stromal vascular fraction for alopecia areata. Stem cell research & therapy, 9(1), 141. https://doi.org/10.1186/s13287-018-0889-y
[8] Schatton, T., Murphy, G. F., Frank, N. Y., Yamaura, K., Waaga-Gasser, A. M., Gasser, M., Zhan, Q., Jordan, S., Duncan, L. M., Weishaupt, C., Fuhlbrigge, R. C., Kupper, T. S., Sayegh, M. H., & Frank, M. H. (2008). Identification of cells initiating human melanomas. Nature, 451(7176), 345–349. https://doi.org/10.1038/nature06489
[9] Kim, W. S., Park, B. S., Park, S. H., Kim, H. K., & Sung, J. H. (2009). Antiwrinkle effect of adipose-derived stem cell: activation of dermal fibroblast by secretory factors. Journal of dermatological science, 53(2), 96–102. https://doi.org/10.1016/j.jdermsci.2008.08.007