发布时间:2023-08-03 浏览量:0
细胞外囊泡 (EVs)是由细胞释放的膜状天然纳米颗粒,作为天然的纳米颗粒,EV固有地受益于免疫耐受性、循环系统的稳定性以及穿越生物屏障到达大脑等远处器官的能力。
为了准确评估EVs的治疗潜力,体内应用实验是必不可少的。准确可靠的给药策略对正确评估EV的治疗效果(最低药效学剂量)、药效动力学(PD)和药代动力学(PK)至关重要。
Part 1 EVs应用剂量大有考究
不同的实验动物(大鼠、小鼠、猪)、给药途径(系统性/局部)、研究领域(心血管、神经、炎症、癌症)等,临床前以及临床上所用的EVs剂量大有考究。
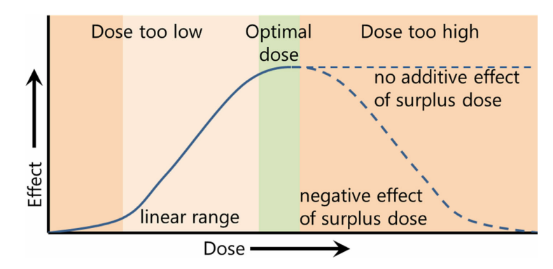
△图1.EVs量效关系图
Part 2 EVs剂量的影响因素
1.计量方法(蛋白量/颗粒数)与剂量
大多数研究以蛋白量来量化EVs在体内的应用剂量,部分研究以RPS或NTA计算EVs的颗粒数,以颗粒数量化EVs在体内的应用剂量。但无论哪种计量方法,EVs有效剂量的范围、治疗频次均存在很大的差异。
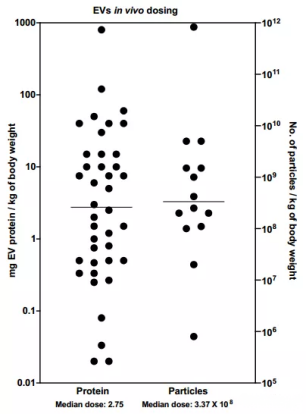
△图2.计量方法(蛋白量/颗粒数)与EVs剂量
2.给药方式与剂量
体内实验的给药方式分为系统给药和局部给药,通过统计分析动物实验所用EVs的给药方式发现,系统性给药途径的应用较多,如静脉注射。
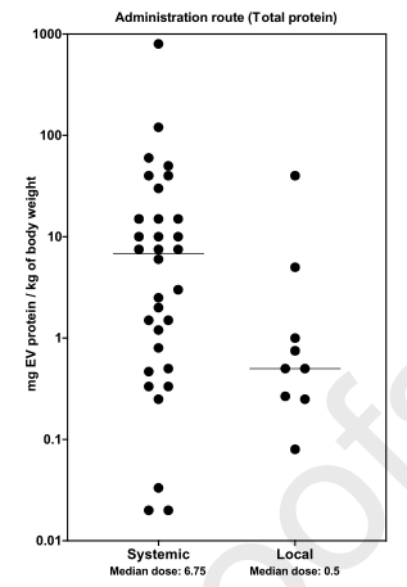
△图3.给药方式与EVs剂量
3.实验动物与剂量
研究中EVs剂量的变化是否主要是由于动物物种的差异?
由于高等动物的代谢率和体表面积重量比较低,大型动物往往需要较低的剂量才能观察到类似的治疗效果。大型动物的中位治疗剂量低于小型动物。
因临床前使用的动物种类不同,缺乏对体内剂量反应动力学进行全面评估的研究,目前仍无法解决EVs给药不一致的问题。
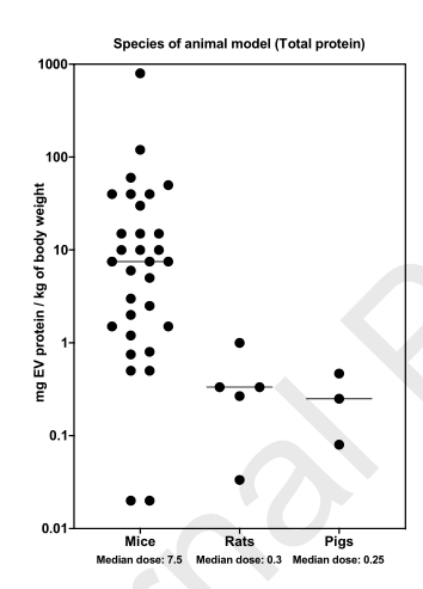
△图4.实验动物与EVs剂量
4.制备方式与剂量
直接分离方法(如沉淀或超滤),根据大小或密度使用EVs纯化方法(超离、尺寸排阻等),用于EVs纯化的技术会影响最终制备中外泌体的总蛋白质数量。有趣的是,使用直接分离方法(如沉淀或超滤)的研究中的中位治疗剂量比使用基于大小或密度的EVs纯化方法的研究低约10倍。
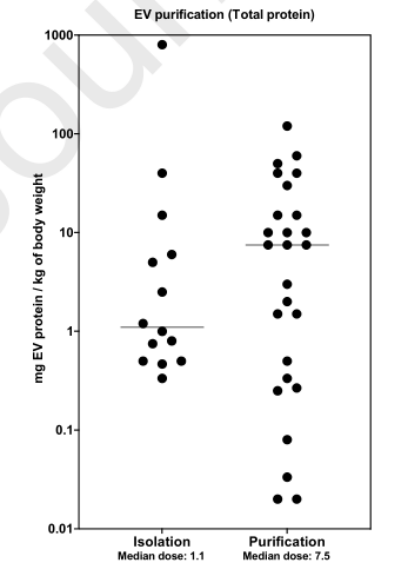
△图5.制备方式与EVs剂量(蛋白计量)
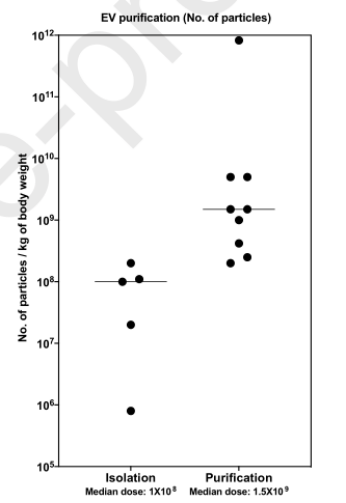
△图6.制备方式与EVs剂量(颗粒数计量)
5.适应症与EVs剂量
不同适应症动物实验所用的EVs剂量也存在很大差异,目前研究较多的是心血管疾病、神经系统疾病、炎症性疾病等。大多数EVs药代动力学研究都是在野生型(WT)动物模型中进行的。
由于EVs具有靶向目标病变器官的能力,EVs在患病动物中的分布也可能存在很大的差异。
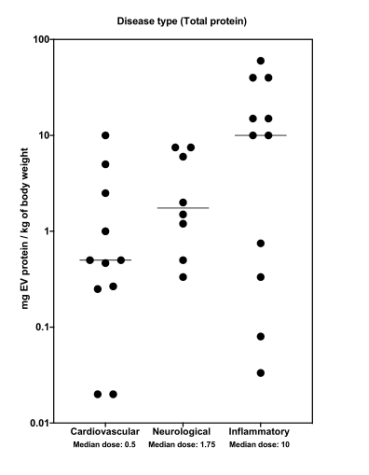
△图7.适应症与EVs剂量
Part 3 文末小结
目前外泌体临床前研究的实验动物以小鼠为主,给药方式多为尾静脉注射。大多数已发表的关于间充质细胞及其细胞外囊泡的临床试验均为静脉给药方式。在这些研究中,虽然治疗的安全性已经得到肯定,但它们的治疗效果并不显著,这或许在于给药剂量的差异。不同研究中使用的外泌体剂量不尽相同,因此以上内容仅供参考,具体用量建议正式实验前,可通过设置不同剂量梯度的预实验来摸索合适的外泌体用量。
尽管外泌体在动物实验及临床应用上取得不错的进展,但外泌体的纯化方法、表征、定量方式等缺乏统一的标准,不同研究之间差异较大,因此需要建立统一的标准操作流程和检测方法,保证批次间的可靠性,提高应用之间的可重复性。
山东省齐鲁细胞治疗工程技术有限公司以标准化、良好表征、经过中检院质量复核的脐带间充质干细胞作为外泌体制备的种子细胞,建立了标准化可量产的外泌体纯化平台以及完善的检测体系。


△图8. 外泌体制备与检测鉴定平台
参考资料
[1]Gupta D, Zickler AM, El Andaloussi S. Dosing extracellular vesicles. Adv Drug Deliv Rev. 2021 Nov;178:113961. doi: 10.1016/j.addr.2021.113961. Epub 2021 Sep 2. PMID: 34481030.



