发布时间:2023-04-23 浏览量:0
前言
目前糖尿病属于全球性疾病之一,据统计在世界范围内糖尿病患者人数已从 1980年的1.08亿人上升至2021年的5.37亿人,发病率从4.7%增加至9.3%,呈显著上升趋势,据估计2030年会突破10%。
糖尿病各种并发症以及治疗的不良反应在很大程度上影响着患者的生活质量,威胁着患者的生命健康。糖尿病已经成为一个严重的全球公共卫生问题。而当前治疗糖尿病的临床方法有限,主要是利用药物将血糖控制在一个相对稳定的水平。
与传统的血清或尿液等生物标志物相比,外泌体作为生物标志物具有更好的稳定性[1]。近年来,外泌体在糖尿病及其并发症中作用的研究如火如荼的进行着。对于外泌体的研究,一方面可以为糖尿病的早期诊断提供新的生物标志物;另一方面,通过对外泌体在代谢应激条件下启动的通路进行分子解剖,有助于对糖尿病及其相关代谢性疾病的病理生理学进行更深入的了解[2]。

△图1 外泌体调控糖尿病的病理过程
关于糖尿病
糖尿病分为胰岛素绝对缺乏的Ⅰ型糖尿病(T1DM)、胰岛素相对缺乏的Ⅱ型糖尿病(T2DM)、妊娠糖尿病(GDM)以及其他特殊类型糖尿病四种类型。
T1DM和T2DM是临床患者中观察到的较常见的糖尿病类型。T1DM是一种自身免疫性疾病,其中免疫系统不恰当的影响了胰腺中的β细胞并去除了其胰岛素分泌能力,从而降低了调控血清葡萄糖水平的能力。T2DM是糖尿病中最为常见的类型,大约占90%左右,其特点是胰岛素缺乏的同时,伴有胰岛素作用靶组织出现不同程度的胰岛素抵抗,而且大多患者有肥胖症状。另外,GDM发生在孕妇中,导致对胰岛素的敏感性显著降低。
你了解外泌体吗?
细胞外囊泡是由细胞释放的,直径为30~40nm到8~9um具有膜结构的囊泡的统称,根据生物合成或释放途径不同,细胞外囊泡又可分为凋亡小体、微囊泡和外泌体等[3]。
外泌体是直径为30~150nm的膜囊泡,来源于晚期内体途径,由多泡体与质膜融合后释放到细胞外空间,通过传递微RNA(microRNA和miRNA)、蛋白质、长链非编码RNA、环状RNA和DNA,介导相邻或远端细胞之间的信号转导,发挥抗炎和抗肿瘤作用[4],几乎所有的细胞均可分泌外泌体。
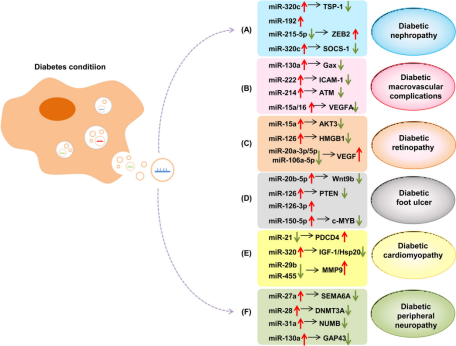
△ 图2 外泌体miRNA与糖尿病相关并发症的关系
注:在糖尿病过程中,外泌体miRNA被受体细胞吸收并发挥其生物学功能,从而调节糖尿病相关并发症的进展。
外泌体的提高胰岛素敏感性的功能
在高脂肪饮食和链脲佐菌素注射下诱导的T2DM大鼠模型中,尾静脉注射人脐带间充质干细胞来源外泌体后,可以改善大鼠的糖耐量,提高胰岛素敏感性, 表现为空腹血糖明显下降和体重显著降低[5]。
有研究发现,外泌体对改善糖尿病患者胰岛功能和肝脏糖脂代谢有显著功效,患者治疗后实现降糖或停用胰岛素,C肽水平升高,生活质量提升。临床研究发现,糖尿病患者接受外泌体移植治疗1年后,血糖控制水平较移植前明显改善,糖化血红蛋白显著下降,检查显示移植的胰岛细胞存活并保持良好功能,胰岛功能恢复有效率达90%以上。
外泌体的促进
受损胰腺β细胞修复再生功能
糖尿病的病理解剖均呈现为细胞损伤性疾病。由于胰岛β细胞的功能被破坏而缺失,造成胰岛β细胞数量减少,胰岛素分泌不足或胰岛素产生抵抗,从而导致血糖升高,形成糖尿病。
外泌体疗法以其极强的自我更新能力及多向分化潜能成为获得大量胰岛β细胞的最佳种子细胞来源。目前已证实人脐带间充质干细胞、人诱导多能干细胞来源间充质干细胞可以分化为胰岛素分泌细胞。通过将外泌体移植到糖尿病患者体内,利用细胞外泌体的生物学特性,重启患者机体自身修复和再生能力,不断修复体内受损的胰岛组织和替代受损的胰腺β细胞,恢复胰岛功能,促进胰岛素分泌,从而达到临床治愈糖尿病及其并发症目的[6]。
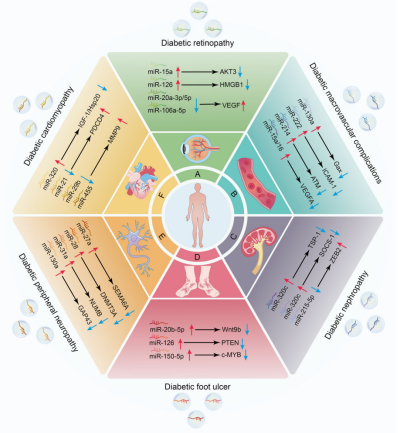
△
△图3 外泌体调控糖尿病相关并发症进展的分子机制
展望
外泌体在体液中的稳定循环及其与反应病程具有一致性的特点,为外泌体作为糖尿病及其并发症的生物标志物提供了基础。
此外,与细胞疗法相比,外泌体疗法稳定性更高,储存和管理更容易,移植安全隐患更小,免疫排斥反应可能性更低,为开发新的治疗应用提供了条件。对于外泌体的深入基础和临床研究可以帮助我们深入了解代谢性疾病的发生机制,为糖尿病及其并发症防治提供新的思路与方向,必将成为糖尿病及其并发症患者的福音。
~end~
参考文献:
[1] Guay C, Regazzi R. Circulating microRNAs as novel biomarkers for diabetes mellitus. Nat Rev Endocrinol. 2013;9(9):513-521.
[2] Rottiers V,Naar AM. MicroRNAs in metabolism and metabolic disorders. Nat Rev Mol Cell Biol. 2012;13(4):239-250.
[3] Pfeifer P,Werner N,Jansen F.Role and function of microRNAs in extracellular vesicles in cardiovascular biology. Biomed Res Int. 2015;2015:161393.
[4] Fu Q, Jiang H, Wang Z, et al. Injury factors alter miRNAs profiles of exosomes derived from islets and circulation. Aging(Albany NY). 2018;10(12):3986-3999.
[5] Tsukita S, Yamada T, Takahashi K, et al. MicroRNAs 106b and 222 improve hyperglycemia in a mouse model of insulin deficient diabetes via pancreatic beta-cell proliferation. EBioMedicine. 2017;15:163-172.
[6] Xu H, Du X, Xu J, et al. Pancreatic beta cell microRNA 26a alleviates type 2 diabetes by improving peripheral insulin sensitivity and preserving beta cell function. PLoS Biol. 2020;18(2):e3000603.

