发布时间:2023-04-10 浏览量:0
前言
慢性神经退行性疾病是一类复杂的异质性疾病,其病因迄今不明,可能包括遗传和环境等多种因素,该病的主要特征是特别脆弱的神经群体渐进性损失。慢性神经退行性疾病,包括阿尔茨海默病(AD)、帕金森病(PD)、肌萎缩性侧索硬化症(ALS)和亨廷顿病(HD)[1]。该病表现出完全不同的神经病理,神经元死亡的途径是多维度的,这使得不可能确定和设计一个有效和实用的治疗策略。随着全球人口老龄化的加剧,受慢性神经退行性疾病和社会严重医疗问题影响的人数在未来几年会急剧增加,这突出表明发展新的和更有效的治疗方法的重要性。
目前,干细胞技术被认为是治疗PD、HD、AD和ALS的一种令人兴奋和可行的技术。间充质干细胞(mesenchymal stromal cells, MSCs)可以有效地从成人组织中分离出来,在培养物中体外培养,并以自体或异体安全的方式进行移植,因此在细胞治疗方面具有巨大的潜力[2]。MSCs被发现能够向神经细胞分化,并分泌多种分子,反过来帮助修复神经组织(图1)。
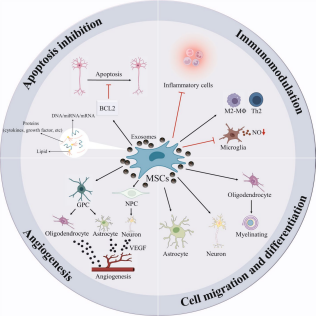
△图1 慢性神经退行性疾病中MSC介导的神经修复的潜在机制
MSCs在AD治疗中的应用
在AD临床前模型中,MSCs可以提高mTOR、AMPK、GSK-3β、Wnt3和β-catenin的生存相关靶点的表达水平(图2)[3]。对AD小鼠SAMP8模型的研究也表明,MSCs可以使受损的神经细胞的功能得到恢复并改善小鼠的认知功能[4]。最近的研究,MSCs与白藜芦醇联合用药可能是AD有效治疗的又一种选择,白藜芦醇能更有效地在AD小鼠模型的海马区植入MSCs,改善其学习和记忆,增强神经再生,减少神经损失。
临床研究报道,通过在AD患者海马和楔前叶注射异体MSCs可能产生影响实验中,患者使用含有3或6×106细胞的60ul细胞悬液,在2年的随访中,这种干预没有发生不必要的严重事件,也没有剂量限制毒性。常见的不良影响有手术伤口疼痛、头痛、头晕和术后谵妄。因此,MSCs移植的安全性和可行性得到了证实。
△图2神经细胞内的信号轴反应
MSC在PD治疗中的应用
研究表明,在PD小鼠模型中,注射MSCs后,它可以到迁移到脑部损伤区、分化为多巴胺能神经元和增强纹状体内的多巴胺水平,MSCs支持血脑屏障的完整性,避免了黑质致密处甘露糖结合凝集素的流入,从而抑制了小胶质细胞功能,并抑制了多巴胺能神经元的损伤[5]。此外,MSCs和其他分子的联合治疗,可以增强MSCs介导的神经保护作用。比如,在PD动物模型中,氧化铁纳米颗粒显示了增强MSCs治疗作用的能力,这种作用主要通过三种机制来实现:
①增强MSCs向病变部位的迁移;
②促进MSCs向多巴胺能神经元的分化;
③减少宿主多巴胺能神经元的损失。
2009年的一项临床试验首次验证了在7例PD患者中单侧给予自体MSCs的安全性和有效性。在10~36个月的随访中,7名参与者在“统一帕金森病评分量表(UPDRS)”上的得分均有明显改观,其症状也有显著改善,如面部表情、步态和冻结发作。
MSC在HD治疗中的应用
在神经毒素-硝基丙酸诱导的HD大鼠模型中,通过MSCs在纹状体内移植,显著降低了小胶质细胞的激活和TNF-α的表达,并减少了纹状体的坏死。同样,在喹啉酸诱导的HD大鼠模型中,MSCs可以改善运动功能障碍,同时维持纹状体体积。科学家们一直致力于开发一种低侵入性给药途径,如鼻内给药。这在R6/2 HD转基因小鼠的运动活性评估中得到了证实,在该研究中MSCs在嗅球、中脑和纹状体中被识别,并促进体内多巴胺、磷酸化蛋白和TH蛋白的表达,致使被治疗小鼠的症状得以改善。因此,鼻内给药可能是HD中MSCs治疗的另一种途径[6]。
目前在HD患者中进行MSCs治疗的可靠性和安全性评估方面还没有临床的注册试验。
MSC在ALS治疗中的应用
有研究报道,通过体内、椎管内或全身给药MSCs后,可改善ALS病程,并部分延长治疗鼠的总生存期,经过治疗的啮齿类动物,其运动能力得到改善,胸部和腰椎水平的运动神经元数量增加。另外,通过对ALS小鼠进行脑室内给药与椎管内单次重复给予MSCs的比较,显示椎管内给药轻微提高了治疗小鼠的总生存率,而通过脑室内途径给药的MSCs刺激了小胶质细胞分裂,并显著降低了治疗动物的总生存率,这表明对于ALS的治疗,通过脊髓内途径进行MSCs移植相比于脑室内移植更合理[7]。
2003年,Mazzini等人首次对ALS患者椎管内注射自体MSCs的可行性和安全性进行了评估。受试者除了适度肋间疼痛外,没有患者出现其他严重不适。此外,在脊髓中未发现异常细胞生长的情况,提示干预是安全的,且耐受性良好。
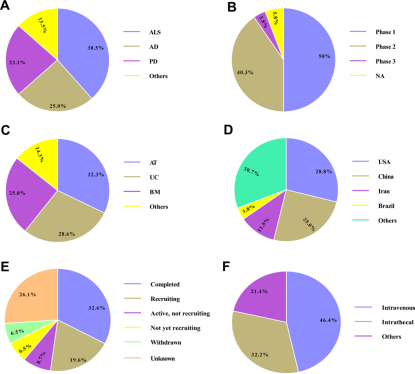
△
图3基于MSCs治疗慢性神经退行性疾病的临床试验在ClinicalTrials.gov上的注册信息
展望
干细胞移植技术,尤其是MSCs的移植,为神经系统疾病带来了新的治疗办法,除细胞替代之外,MSCs的免疫调节、营养作用、神经保护以及刺激细胞再生等作用都有一定的临床应用价值。这种细胞疗法代表了一种潜在的途径,该途径最终将为患者的康复带来福音。
目前全球正在积极建立医疗监管准则和标准,以确保患者治疗的安全性,这便为相关科研工作者和医护人员指明了将来努力的方向。相信在不久的将来,干细胞疗法必将对人类健康产生举足轻重的影响。
部分文字来源于网络
~end~
参考文献:
[1] Lin R, Li M, Luo M, Teng T, Pan Y, Huang H. Correction to: Mesenchymal stem cells decrease blood–brain barrier permeability in rats with severe acute pancreatitis. Cell Mol Biol Lett. 2019;24(1):56.
[2] Kim SH, Oh K-W, Jin HK, Bae J-S. Immune infammatory modulation as a potential therapeutic strategy of stem cell therapy for ALS and neurodegenerative diseases. BMB Rep. 2018;51(11):545.
[3] Lo Furno D, Mannino G, Giufrida R. Functional role of mesenchymal stem cells in the treatment of chronic neurodegenerative diseases. J Cell Physiol. 2018;233(5):3982–99.
[4] Li Q, Yu P, Wang W, Zhang P, Yang H, Li S, Zhang L. Gene expression profles of various cytokines in mesenchymal stem cells derived from umbilical cord tissue and bone marrow following infection with human cytomegalovirus. Cell Mol Biol Lett. 2014;19(1):140–57.
[5] Gorabi AM, Kiaie N, Barreto GE, Read MI, Tafti HA, Sahebkar A. The therapeutic potential of mesenchymal stem cell–derived exosomes in treatment of neurodegenerative diseases. Mol Neurobiol. 2019;56(12):8157–67.
[6] Tatullo M, Codispoti B, Spagnuolo G, Zavan B. Human periapical cyst-derived stem cells can be a smart “lab-ona-cell” to investigate neurodegenerative diseases and the related alteration of the exosomes’ content. Brain Sci. 2019;9(12):358.
[7] Chen C, Huang H, Hu W, Li X. Mesenchymal stem cell-derived exosomes for the treatment of neurodegenerative diseases: existing problems and prospects in application. Chin J Tissue Eng Res. 2019;23(9):1441.

