发布时间:2022-12-29 浏览量:0


视网膜疾病是一组异质性疾病,它包括老年性黄斑变性、色素性视网膜炎和糖尿病视网膜病变,导致视网膜退化的原因较多,如氧化应激、遗传疾病、光诱导损伤、化学损伤、血管缺陷或衰老等[1]。视网膜疾病的特征是神经元的进行性退化,其主要发生在光感受器、视网膜神经节细胞和视网膜色素上皮中,该过程会严重影响视觉功能,若不进行有效的干预,最终会导致永久性的失明。
美国食品和药物管理局(FDA)批准的抗血管内皮生长因子(VEGF)药物的临床试验中,报道称贝伐单抗(Avastin)和兰尼单抗(Lucentis)有改善视力的功效。抗VEGF抗体可以选择性地结合并存在于血管化眼内组织(如结膜、虹膜和视网膜)上的VEGF受体,从而可以阻止那些导致眼内病理性血管形成的促炎细胞因子的大量释放[2]。但是这些治疗方法需要给患者多次用药以及玻璃体内注射重复给药,以维持视力。2016年,患者在抗VEGF抗体治疗后出现抗血小板临床试验事故,比如非致死性中风和血管性死亡。因此,迄今为止还没有一种有效且安全的治疗视网膜疾病的方法。
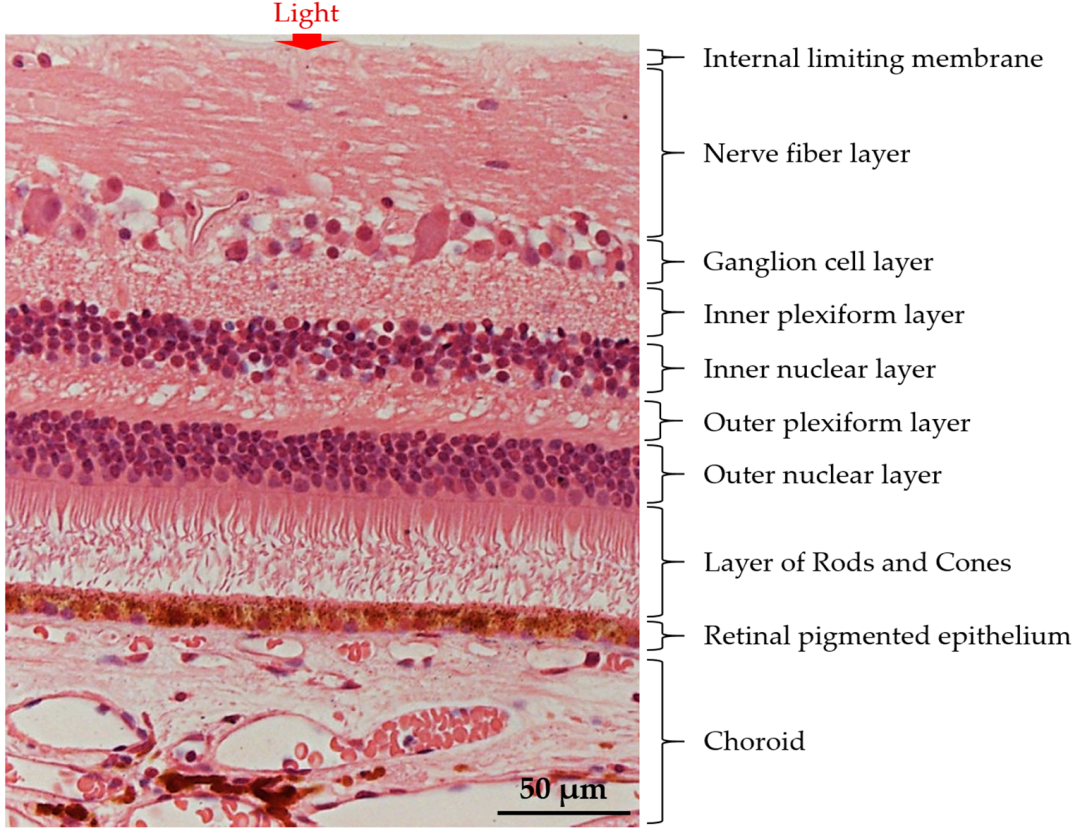
图1:视网膜的基本结构

干细胞是一种具有较高自我更新能力和分化能力的细胞,是目前最受欢迎的作为细胞替代治疗的候选者。在视网膜退行性疾病中,研究工作的重点为通过遗传、化学或机械操作,以未修饰或修饰的干细胞的输注来改善终末分化的视网膜神经元细胞的细胞恢复和再生。
胚胎干细胞具有惊人的多胚层分化潜力,可以定向形成几乎任何类型的细胞。一些临床试验已经评估了胚胎干细胞对老年性黄斑变性和色素性视网膜炎患者的有效性和安全性。有研究报道,胚胎干细胞移植到视网膜下22个月内,没有出现不良增殖和免疫排斥的现象。在最近的另一项研究中,I/II期临床试验的初步数据报道,从胚胎干细胞中提取的着色上皮细胞异体移植1年后,老年性黄斑变性患者的视力得到改善,没有任何与细胞移植相关的不良反应或肿瘤形成的现象[3]。尽管如此,胚胎干细胞的使用经常会引发伦理性的问题,而且需要与免疫抑制药物联合治疗,以避免出现异体移植的免疫排斥反应。
诱导多能干细胞,由体细胞诱导为多能状态而来,避免了使用人类胚胎的伦理争议。然而2015年的一项研究中,在移植前的细胞诱导过程中发现了基因突变现象,这一发现导致研究后续工作全面终止。大量文献报道,诱导多能干细胞的致瘤性与胚胎干细胞的致瘤性相似,是细胞治疗的主要临床障碍。细胞分化的风险,基因组不稳定,以及在细胞诱导中存在未分化体细胞的情况都会使患者在治疗过程中出现病情恶性。
为了克服异体或自体移植过程中排斥的风险,研究人员将重点放在MSCs上。MSCs大量存在于成人组织中,如骨髓、脂肪组织和牙髓,以及胎儿组织和体液中。除了分布广泛外,MSCs不受伦理限制,对恶性转化的敏感性最小,而且能够避免免疫细胞识别,因此MSCs在异体和自体细胞移植中拥有良好的应用前景。
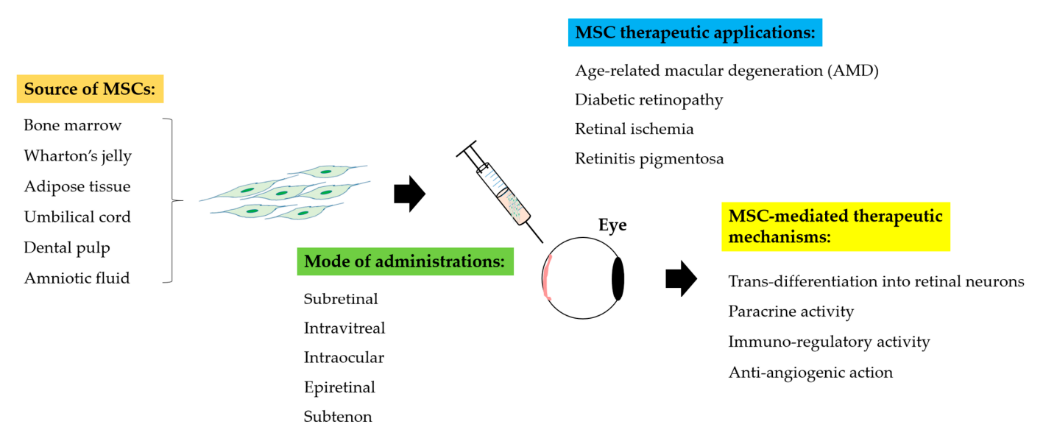
图2:MSCs在视网膜疾病中的治疗策略

眼内免疫系统失调是一种病理状态,其表现为促炎细胞因子、趋化因子、基质金属蛋白酶的大量释放,逐渐导致内皮紧密连接蛋白的丢失,从而促使免疫细胞浸润,便会导致视网膜黄斑变性、青光眼和葡萄膜炎等。也有人认为,当发生自身免疫反应时,也会波及到眼睛,比如葡萄膜黑色素、光间受体类视黄酮结合蛋白和恢复蛋白,这些抗原在视网膜、晶状体和角膜中表达。反过来,这将触发抗原激活CD4+T细胞亚群,释放转录因子,这些转录因子对激活自身免疫相关的T辅助细胞增殖至关重要,如Th1细胞的IL-12和IFN-γ,以及Th17细胞的IL-6、IL-21、IL-23和TGF-β[4]。
大量研究表明,MSCs作为一种有效的免疫研究候选者,可以调节先天和适应性免疫反应,抑制包括视网膜疾病在内的多种疾病的免疫反应。它们的免疫逃避状态可能是由于缺乏活化的HLA-I的T细胞相关配体和来自HLA-II的共刺激分子,包括CD40、CD80和CD86,这些分子负责通过T细胞活化触发移植物排斥反应。此外,这些细胞能够下调异基因淋巴细胞增殖,并刺激T调节细胞表达[5]。2015年,在一项炎症介导的小鼠视网膜疾病模型的实验中,在眼周输注MSCs后,小鼠视网膜病变部位被修复,并伴随着促炎细胞因子活性和CD4+T细胞浸润的下调。同时有对照研究报道,MSCs通过旁分泌TGF-β促进调节性T细胞和FOXP3转录因子对T细胞应答具有抑制作用。
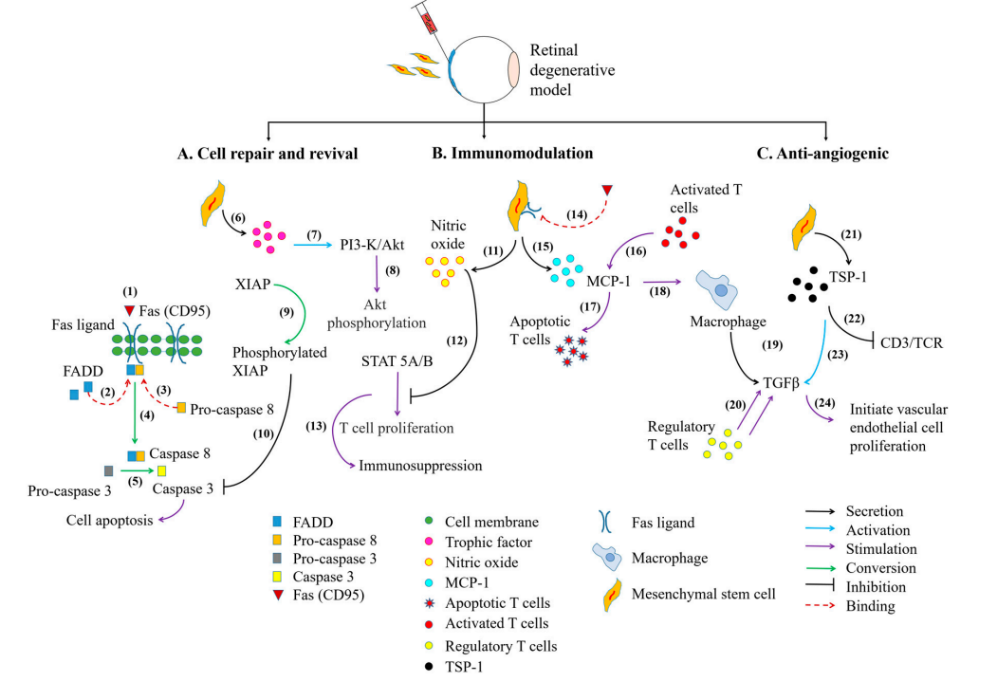
图3:眼内MSCs介导的治疗作用的信号通路

大量的临床前和临床研究证实了MSCs在眼新生血管恢复中的治疗潜力。有研究报道,在化学制剂诱导的大鼠视网膜疾病模型中,通过结膜下注射骨髓来源的MSCs,发现通过抑制VEGF、MMP-9和toll样受体,促进了角膜创面的愈合并新生血管生成。在缺氧致视网膜病变小鼠模型中,经腹腔移植人胎盘羊膜来源的MSCs到损伤部位,发现MSCs大量释放血管生成转化因子TGF-β1。令人惊讶的是,TGF-β1水平的上调显著降低了无新生血管的内皮细胞增殖,同时恢复了视网膜血管生成功能。
对于MSCs的探索已经逐渐从实验室阶段进入到临床阶段。在视网膜疾病治疗领域的研究中,由自身免疫及炎症导致的病理变化,MSC的治疗具有有极大的潜力,尤其在葡萄膜炎和黄斑变性相关的治疗方面,但还需要进一步积累临床数据。对于视网膜疾病的治疗,有待进一步观察MSCs应用的有效性,未来可参考胚胎干细胞和诱导多能干细胞的研究思路。总之,MSCs在视网膜疾病的转化应用上前景可期,但尚需选择合适的适应症,进行更多研究。
参考文献
[1] Ng, T.K.; Yung, J.S.Y.; Choy, K.W.; Cao, D.; Leung, C.K.S.; Cheung, H.S.; Pang, C.P. Transdifferentiation of periodontal ligament-derived stem cells into retinal ganglion-like cells and its microRNA signature. Sci. Rep. 2015, 5, 16429.
[2] Worthington, K.S.; Green, B.J.; Rethwisch, M.; Wiley, L.A.; Tucker, B.A.; Guymon, C.A.; Salem, A.K. Neuronal differentiation of induced pluripotent stem cells on surfactant templated chitosan hydrogels. Biomacromolecules 2016, 17, 1684–1695.
[3] Nicoară, S.D.; S, us,man, S.; Tudoran, O.; Bărbos, O.; Chereches, , G.; As,tilean, S.; Potara, M.; Sorit,ău, O. Novel strategies for the improvement of stem cells’ transplantation in degenerative retinal diseases. Stem Cells Int. 2016, 2016, 1236721.
[4] Schwartz, S.D.; Regillo, C.D.; Lam, B.L.; Eliott, D.; Rosenfeld, P.J.; Gregori, N.Z.; Hubschman, J.P.; Davis, J.L.; Heilwell, G.; Spirn, M.; et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet 2015, 385, 509–516.
[5] Schwartz, S.D.; Tan, G.; Hosseini, H.; Nagiel, A. Subretinal transplantation of embryonic stem cell-derived retinal pigment epithelium for the treatment of macular degeneration: An assessment at 4 years. Investig. Ophthalmol. Vis. Sci. 2016, 57, ORSFc1–ORSFc9.

