发布时间:2022-03-07 浏览量:0

间充质干细胞(MSCs)是具有自我更新、多向分化、旁分泌和免疫调节作用的多能细胞。由于这些特性,MSCs具有很大的临床应用前景,特别是在损伤组织的再生、功能重建和细胞治疗方面。间充质干细胞可以从不同的组织中分离出来,例如骨髓(BM),脐带(UC),羊水,经血,外周血,脂肪组织(AD),胎盘和月经液,如图1所示。
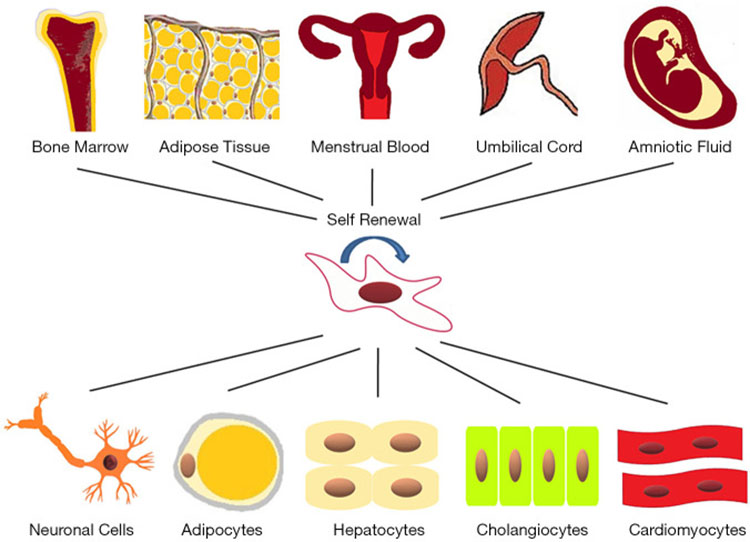
间充质干细胞 (MSCs)具有多项分化、免疫调节(低免疫原性)、促进组织器官的修复等功能特性,用于临床应用的 MSC 最吸引人的特征之一是它们的免疫调节特性,它们通过产生和释放各种营养因子来充当免疫导体,以刺激邻近的细胞开始修复受损组织。基于干细胞疗法已成为再生医学领域的一种新方法,用于治疗各种疾病,以修复和/或替换受损的细胞和组织[1]。
1、分化可能不是间充质干细胞的治疗机
MSCs 治疗的概念已经扩大到对其他细胞发挥有益作用的生物活性分子细胞,这显著增加了 MSC 治疗应用的范围,这主要与它们的旁分泌特性有关[2]。在以往的研究中,干细胞治疗肝病已被证明在基础和临床研究中均有效。
根据目前的研究,干细胞疗法通过抗细胞凋亡和免疫调节的方式使肝功能得到显著改善。间充质干细胞可通过分泌多种免疫调节因子在肝纤维化的治疗中发挥关键的治疗作用。MSCs 治疗后,包括肝细胞生长因子 (HGF) 和胰岛素样生长因子 (IGF-1) 在内的抗凋亡因子升高,同时对血管生成和有丝分裂生成因子的分泌有促进作用[3]。
2、MSC的体内迁移和归巢能力
MSCs 的治疗效果高度依赖于它们的体内迁移和归巢能力。迁移方向由 MSCs 上表达的趋化因子受体和组织中的趋化因子决定,归巢效应即允许细胞导航到损伤或炎症部位。研究已经证实,外源施用的 MSCs 可以在受损组织中发现,但细胞扩增后会导致归巢效应降低。例如,趋化因子受体CXCR4在原代骨髓间充质干细胞上高表达,但随着传代逐渐消失,导致对其配体CXCL12 的识别较少[4]。
在另一项研究中观察到,注射后的 MSC 在肺部被包裹两天后重新分布到伤口部位,可能会限制 MSCs 对肺以外损伤组织的靶向效率。此外MSCs 来源对其归巢能力也有一定影响,可能是由于细胞表面受体存在的一些差异。Senthilkumar 等人表明:胎盘来源的 MSCs 比骨髓来源的 (BM)-MSCs具有更高的扩增和植入活性,牙髓来源的 MSCs 对受损神经元的归巢能力显著高于 BM-MSCs[5]。
3、间充质干细胞临床应用的质量安全性
间充质基质细胞(MSCs)作为先进的治疗产品,必须满足临床使用药品的所有要求,旨在保持细胞的质量和安全性[6]。MSC培养基、细胞来源、培养环境、存储方式和长期体外扩增中的遗传稳定性都会对MSC的产品的表型和临床用途产生影响[7]。就长期体外扩增来说,原代MSC经过不断的体外培养,细胞会不可避免地出现胞龄过大等其他复制性衰老现象,从而导致MSC的细胞质量下降,随后其代谢特征发生改变。
同时在MSC 的生产和临床交付时,需把握符合 GMP 的 MSC 生产的关键步骤:扩增过程,扩增过程的验证:包括对 MSC 的表征、功能、效力和安全性的所有质量控制,以保证患者输液的安全。
齐鲁细胞治疗公司的脐带间充质干细胞制剂已成功通过中检院的质量复核认证,所涉检测项目包括10大项,45个小项。细胞鉴别、分化能力、干性基因、增殖能力、免疫抑制能力等均符合脐带问充质干细胞特性,所有检测项目均符合规定。


4、间充质干细胞从工作台到床边的技术转化面临的挑战
在制备MSC产品期间,主要挑战包括:
1、MSCs的异质性是由供体差异引起的,例如健康状况,遗传学,性别和年龄;
2、从不同来源(如骨髓、脂肪组织、脐带或肌肉)分离的MSCs之间的干性和不同程度的分化能力的稳定性;
3、不同培养条件下不同扩增能力水平,包括汇合、培养表面、氧水平、烧瓶/生物反应器、传代次数和细胞表面修饰。
在应用状态下,仍然存在一定的风险挑战。
不同给药途径(局部/全身),注射位点,输注时间和细胞载体材料下MSCs的归巢或迁移能力的影响,其仍然存在挑战
供体和受体之间的免疫相容性是降低排斥反应风险的关键,但环境炎症分子又会诱导MSHC-II在MSCs中的表达上调[8],进而增加排斥反应的风险。

图2.:间充质干细胞临床应用的主要挑战
5、未来与展望
MSCs 疗法在过去几十年中取得了巨大的进步,但仍有大量挑战需要克服,迫切需要进一步大规模精心设计的临床前和临床研究。越来越多的研究集中在克服这些缺点的尝试上。尽管 MSCs 免疫调节作用的详细机制仍然难以捉摸,任何提高 MSCs 功效的尝试仍然缺乏证据,但临床前研究正在迅速发展,更标准化的临床试验正在广泛开展。可以预期,向规范注册的 MSC 疗法的转换将随着时间的推移而蓬勃发展。
参考文献:
[1] Zhang, S., Yang, Y., Fan, L., Zhang, F., & Li, L. (2020). The clinical application of mesenchymal stem cells in liver disease: the current situation and potential future. Annals of Translational Medicine, 8(8).
[2] Dabrowska, S., Andrzejewska, A., Janowski, M., & Lukomska, B. (2021). Immunomodulatory and regenerative effects of mesenchymal stem cells and extracellular vesicles: therapeutic outlook for inflammatory and degenerative diseases. Frontiers in immunology, 11, 3809.
[3] Zhu, M., Hua, T., Ouyang, T., Qian, H., & Yu, B. (2021). Applications of Mesenchymal Stem Cells in Liver Fibrosis: Novel Strategies, Mechanisms, and Clinical Practice. Stem Cells International , 2021 .
[4] Pallares V, Unzueta U, Falgas A, Sanchez-Garcia L, Serna N, Gallardo A, et al. An Auristatin nanoconjugate targeting CXCR4+ leukemic cells blocks acute myeloid leukemia dissemination. J Hematol Oncol. 2020;13(1):36.
[5] Su, Y., Zhang, T., Huang, T., & Gao, J. (2021). Current advances and challenges of mesenchymal stem cells-based drug delivery system and their improvements. International Journal of Pharmaceutics, 600, 120477
[6] Torre, M. L., Lucarelli, E., Guidi, S., Ferrari, M., Alessandri, G., De Girolamo, L., ... & Gruppo Italiano Staminali Mesenchimali (GISM). (2015). Ex vivo expanded mesenchymal stromal cell minimal quality requirements for clinical application. Stem cells and development, 24(6), 677-685。
[7] Wang, Y., Han, Z. B., Song, Y. P., & Han, Z. C. (2012). Safety of mesenchymal stem cells for clinical application. Stem cells international, 2012。
[8] Zhou, T., Yuan, Z., Weng, J., Pei, D., Du, X., He, C., & Lai, P. (2021). Challenges and advances in clinical applications of mesenchymal stromal cells. Journal of Hematology & Oncology, 14(1), 1-24.