发布时间:2021-08-17 浏览量:0

2、揭开渐冻症的神秘面纱
渐冻症又称肌萎缩侧索硬化(ALS),是一种快速进展的神经退行性疾病,其特征是运动皮层的上运动神经元和脑干和脊髓腹角的下运动神经元选择性变性,在症状出现后3-5年内,大脑和脊髓内运动神经元的丧失导致肌肉萎缩、无力、瘫痪,最终死亡。
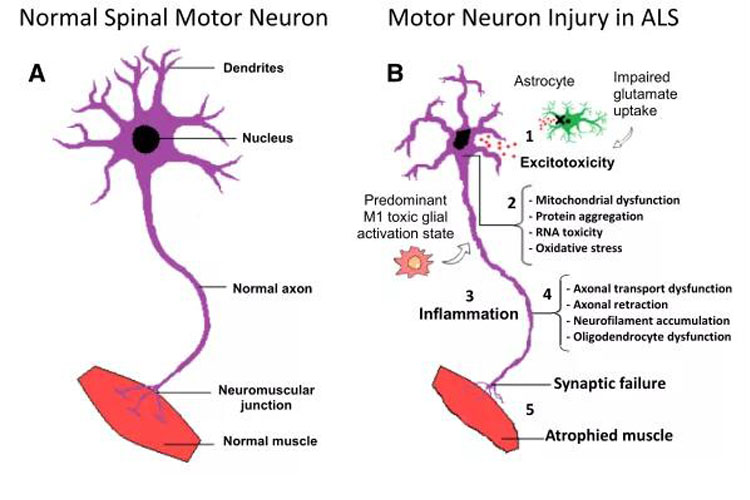
图1. ALS神经元损伤的主要病理机制
几种病理生理机制已被提出,包括:细胞质蛋白定位和聚集异常,蛋白稳态异常,RNA毒性,RNA加工异常,谷氨酸受体过度激活介导的兴奋毒性,线粒体功能障碍,内质网应激和小胶质细胞激活,细胞骨架异常重排,轴突运输受损,氧化应激。此外,小胶质细胞、少突胶质细胞和星形胶质细胞的贡献似乎对疾病的发展至关重要,显著影响疾病发病后的进展速度。事实上ALS被认为是一种非细胞自主疾病,运动神经元变性的开始和进展似乎受到不同种类细胞之间复杂的相互作用以及持续炎症环境的影响,图1显示了ALS病理的分子机制。
疾病病理背后的具体分子机制尚未完全了解,神经保护治疗方案的效果微乎其微,本文将以间充质干细胞(MSCs)为重点,讨论干细胞治疗ALS的进展、挑战和未来方向。
03、干细胞治疗ALS的临床研究进展
近年来,干细胞移植作为一种治疗ALS患者的新疗法得到了广泛的研究,成为一个激烈而有争议的研究领域。在一些临床前研究中,干细胞被证明具有神经保护作用,有效地延迟疾病发作和延长生存时间。尽管干细胞技术有了很大的进步,临床前研究也取得了有希望的结果,但仍有几个问题没有得到解答,如最合适和有益的细胞来源、细胞剂量、给药途径和治疗机制的确定。
不同的机制被提出来解释MSCs在神经保护中的作用。虽然其确切机制尚不清楚,但MSCs分泌的抗炎因子和生长因子可能通过多种方式影响ALS的进展,包括神经可塑性、血管生成和轴突再髓鞘化等内源性再生过程。图2显示了间充质干细胞治疗神经退行性变的可能机制,由于其免疫调节特性,MSCs可以通过抑制树突状细胞的成熟和迁移,抑制淋巴细胞的激活和增殖,以及减少胶质细胞增生来减弱中枢神经系统的炎症反应。此外,MSCs具有抗凋亡的特性,并可能通过调节星形胶质细胞的功能限制兴奋毒性。
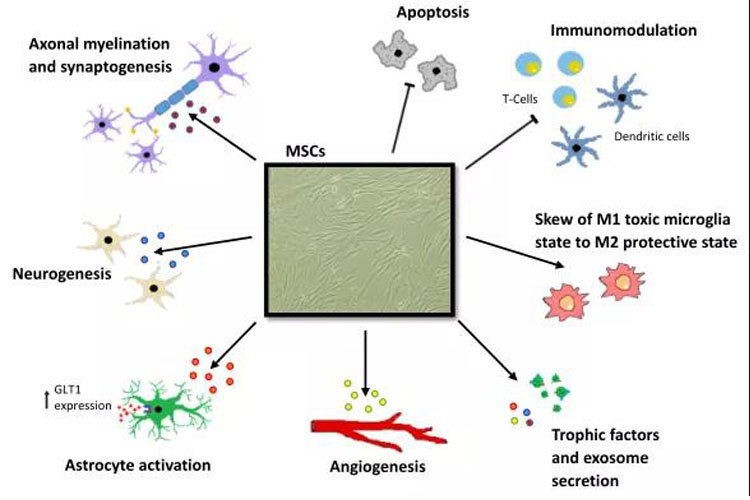
图2. 间充质干细胞治疗神经退行性变的可能机制
04、未来挑战及展望
由于成体间充质干细胞具有高增殖活性、免疫调节、多向分化和分泌神经保护因子的能力,因此,成体间充质干细胞是一种很有前景的临床转化候选细胞。然而,最佳剂量、分化状态、给药途径以及潜在的治疗机制等技术障碍仍有待评估。
最后,我们期待干细胞治疗能够在孤儿病疗领域大放异彩,为渐冻症病人“解冻”,释放他们被禁锢的身心。
参考文献:
[1] Ciervo Y, Ning K, Jun X, Shaw PJ, Mead RJ. Advances, challenges and future directions for stem cell therapy in amyotrophic lateral sclerosis. Mol Neurodegener. 2017 Nov 13;12(1):85. doi: 10.1186/s13024-017-0227-3. PMID: 29132389; PMCID: PMC5683324.
[2] Brites D, Vaz AR. Microglia centered pathogenesis in ALS: insights in cell interconnectivity. Front Cell Neurosci. 2014 May 22;8:117. doi: 10.3389/fncel.2014.00117. PMID: 24904276; PMCID: PMC4033073.
[3] Ooi YY, Dheen ST, Tay SS. Paracrine effects of mesenchymal stem cells-conditioned medium on microglial cytokines expression and nitric oxide production. Neuroimmunomodulation. 2015;22(4):233-42. doi: 10.1159/000365483. Epub 2014 Oct 21. PMID: 25341618.