发布时间:2021-04-13 浏览量:0
CAR-NK的应用前景
嵌合抗原受体修饰T细胞(CAR-T)免疫疗法是近年来迅速发展起来的一种过继性免疫治疗方法,其中CAR通常由抗原结合结构域、跨膜结构域、共刺激信号传导区等组成,其通过基因修饰技术,将能识别肿瘤相关抗原的抗体融合表达于自体T细胞的表面,被修饰过的T细胞因此具有对肿瘤细胞的靶向杀伤力。
CAR-T疗法在急性白血病和非霍奇金淋巴瘤的治疗上取得了巨大的成就,被认为是较有前景的肿瘤治疗方式之一,然而,在CAR-T细胞疗法的临床应用中存在许多缺陷,比如细胞因子释放综合征(CRS)。除了血液系统肿瘤外,研究者们一直在努力将CAR-T治疗扩展到实体瘤,但是利用CAR-T治疗实体瘤(是由异质的细胞群体组成的,这些异质的细胞具有不同的表面分子,并且CAR-T细胞会受到肿瘤微环境的免疫抑制作用)并未取得理想的治疗效果。
自然杀伤(naturalkiller,缩写NK)细胞是非特异性免疫系统的重要组成部分,是先天免疫系统反应的关键性介质细胞。NK细胞是一种广谱免疫细胞,具有快速发现和摧毁异常细胞(如癌症或病毒感染的细胞)的特异功能,而且不需要提前致敏或HLA配型,即可展示强大的溶解异常细胞的活性。使用免疫细胞(包括NK细胞)来治疗癌症是近年来新趋势,这种新疗法有望为对传统手术、化疗和放疗无效的肿瘤提供了新的治愈希望。
本文将着重讨论CAR-NK细胞广阔的应用前景和面临的挑战。
1、CAR-NK的优势
异体NK细胞不会引起移植物抗宿主病(GVHD);
NK细胞治疗不分泌炎症因子(IL1,IL6)致使细胞因子释放综合症发生;
NK细胞具备更多的肿瘤杀伤途径,如执行细胞脱粒、激活凋亡途径和介导ADCC功能;
异体NK细胞来源广泛,包括外周血,脐带血,NK细胞株(NK-92)与诱导多能干细胞(iPSC-NK)等;
NK细胞在体内存活周期短,不同于CAR-T细胞滞留期长,可能会产生一定的副作用;
对实体肿瘤治疗具有明显优势,因为实体肿瘤对非修饰的NK细胞会表现出不同程度的耐受性,但却对抗原依赖型的NK细胞敏感。
2、 NK细胞的来源
目前,NK细胞用于临床实践主要有四个来源:NK细胞系、PBMC(外周血单个核细胞)、UCB(脐带血)、iPSC(人类诱导的多能干细胞)。
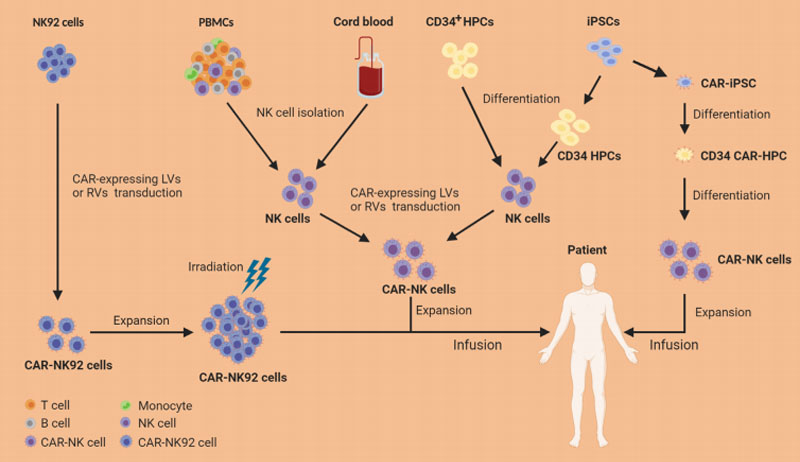
图1.NK细胞来源
3、 CAR-NK改造
取不同来源的NK细胞,进行相关的基因工程改造,并加入相关细胞因子培养并扩增,培养一定体系后冻存,然后需要的时候给患者回输即可,见图2。
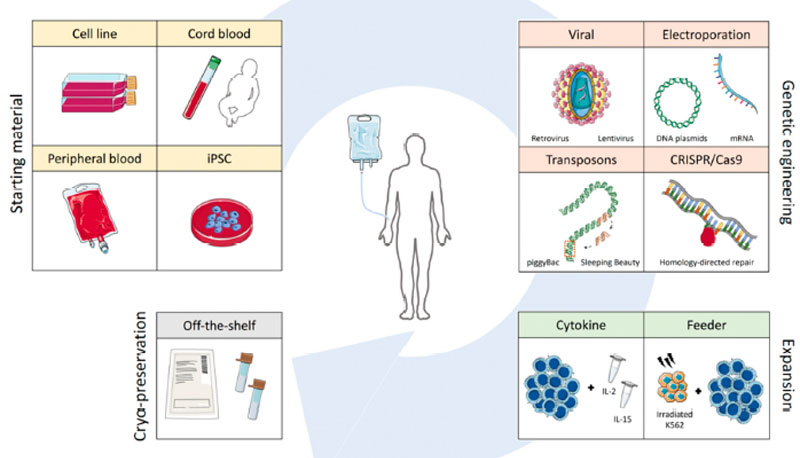
图2.CAR-NK改造过程
4、CAR-NK临床应用
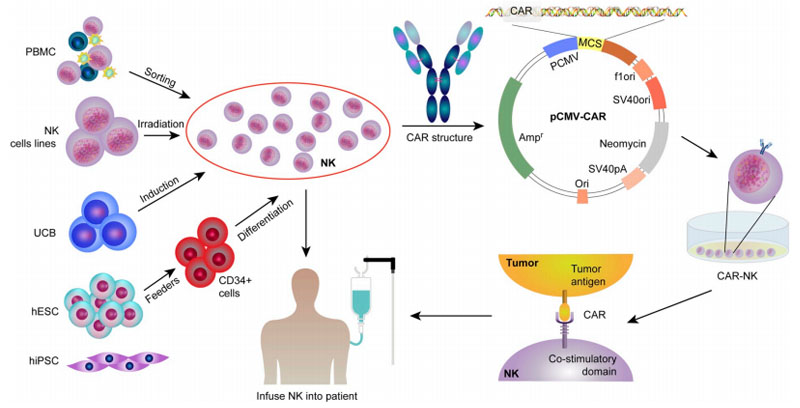
图3.CAR-NK过继疗法临床应用过程
临床试验方面,多集中于血液肿瘤以及尝试解决CAR-T未能解决实体瘤的研究。比较有代表性的是2020年2月发表于《新英格兰医学》(NEJM)杂志的一篇题为UseofCAR-TransducedNaturalKillerCellsinCD19-PositiveLymphoidTumors的临床研究,由来自MD安德森癌症中心的研究者进行。
该研究选择复发难治CD19阳性肿瘤患者,接受来源于脐带血的、HLA不匹配的、CD19特异性CAR-NK细胞治疗。CAR-NK细胞的制备是将表达针对CD19的CAR(CD28-CD3z)、IL-15和诱导性caspase9的逆转录病毒载体转导到NK细胞上,诱导性caspase9的作用在于体内发生毒性反应时触发CAR-NK细胞的凋亡。这些CAR-NK细胞在体外扩增,并在预处理的化疗后以三种剂量(1×105、1×106或1×107个细胞/kg)中的一种单次输注。
结果:共入组11例(5例CLL、4例FL和2例DLBCL)患者,中位随访13.8个月,其中8例对治疗有反应;其中7例完全缓解。治疗反应迅速持久,三个剂量组输注后的30天内可见治疗反应,患者体内的CAR-NK细胞能够扩增并以低水平持续存在至少12个月。CAR-NK细胞治疗的患者中没有发生细胞因子释放综合征、神经毒性或移植物抗宿主病,包括IL-6在内的炎性细胞因子的水平也没有增加。
另外,在实体瘤方面,也取得了骄人的成绩,比如阿思科力研发团队以人体自然杀伤细胞株NK92,通过嵌合Robo1靶点,研发出可以规模化生产的CAR-NK92细胞药物。临床实验表明,CAR-NK注射对于乳腺癌和胰腺癌具有显著疗效,开辟了治疗实体肿瘤的另一条途径。
目前,临床前和临床研究表明,CAR-NK细胞疗法可以发挥重要的抗肿瘤作用,并且比CAR-T细胞疗法更安全。然而,CAR-NK细胞疗法仍然面临一些挑战,例如体外原代NK细胞的扩增和活化,NK细胞产物的储存和运输困难以及转导效率低。
因此,仍需要进一步的研究来优化CAR-NK细胞疗法。构建更好的CAR-NK细胞对于提高治疗效果非常重要,相信随着临床研究的发展,CAR-NK细胞疗法在今后必然会大放异彩。
【参考文献】
[1]LiuE,MarinD,BanerjeeP,etal.UseofCAR-TransducedNaturalKillerCellsinCD19-PositiveLymphoidTumors.NEnglJMed.2020;382(6):545-553.YouHaveGotaFastCAR:ChimericAntigenReceptorNKCellsinCancerTherapy.NEnglJMed.2020February06;382(6):545–553.
[2]XieG,DongH,LiangY,HamJD,RizwanR,ChenJ.CAR-NKcells:Apromisingcellularimmunotherapyforcancer.EBioMedicine.2020;59:102975.
[3]WangW,JiangJ,WuC.CAR-NKfortumorimmunotherapy:Clinicaltransformationandfutureprospects.CancerLett.2020;472:175-180.