发布时间:2020-04-13 浏览量:390
作者寄语:近年来,干细胞药物的陆续上市点燃了再生医学领域的希望之火,成百上千的高校、医院、科研院所、企业等相继报道利好的进展,开启了一个百舸争流的时代。细胞治疗的出现无疑开启了药品研发的新纪元,把药物研发从分子水平提升到了细胞水平,而外泌体的出现又把细胞治疗从细胞维度扩展到了亚细胞维度。本文作为“外泌体系列学术推文”的第一篇,旨在探讨干细胞外泌体疗法的可能性,浅谈个人对于细胞治疗的理解,如有欠妥,权当博君一笑。
公众眼中的干细胞治疗
干细胞是一类具有自我复制能力和多向分化潜能的细胞,其应用以造血干细胞移植为典型,近年来逐渐进入公众的视野。

韩剧有三宝:车祸、癌症、治不好
目前,干细胞疗法的基础和临床研究已在全球范围内展开,主要针对糖尿病、肝硬化、白血病、脑卒中、银屑病、脊柱损伤等多种病症,并取得了显著的成效。传统上认为,干细胞疗法是通过细胞分化替代的方式来修复靶器官中的损伤,从而起到治疗的效果(比如造血干细胞移植治疗白血病)。

(一图秒懂细胞分化)
然而,随着干细胞领域基础和临床研究的进展,越来越多的证据表明,干细胞在很多疾病的治疗当中并不依赖分化替代作用,而是通过旁分泌途径实现的。

MSC的旁分泌途径[1]
干细胞的旁分泌
图太专业了,看不懂?
OK,画个图让你秒懂旁分泌!

个人认为可以从两个角度来理解干细胞治疗的旁分泌假说,一是免疫原性的角度,二是疾病微环境的角度,现以目前临床应用较广泛的间充质干细胞(MSC)为例,予以说明:
其一:众所周知MSC相较终末端分化的细胞而言,具有很低的免疫原性。免疫细胞依靠MHC分子(人类的MHC通常被称为HLA)来识别“自我”和“非我”,而MSC细胞的这种低免疫原性的产生是由于其表面不表达MHC I类分子,并低表达MHC II类分子,因此MSC细胞可以用来异体输注治疗疾病,而不会被受者的免疫系统快速排出。另外,MSC具有很强的免疫抑制能力,这种能力延长了它在异体环境中的存活期,从而进一步发挥作用。但这种“隐身能力”和免疫抑制能力会随着MSC向终末端细胞的分化而逐渐丧失,终末端分化的细胞会重获“身份标签”,进而被免疫系统清除(当然,在有些免疫豁免的器官中可能是另一种情况,比如大脑)。
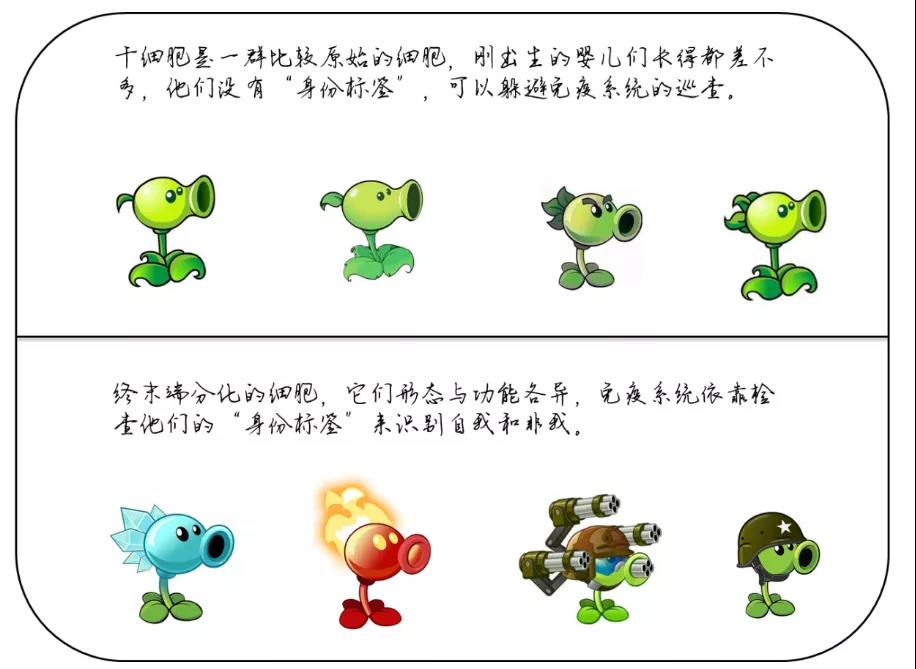
因此若MSC通过细胞分化来发挥治疗作用的话,那么它的疗效应该十分有限。我们的研发人员曾用人脂肪来源的MSC治疗巴马猪的膝关节软骨损伤,结果显示MSC有效地修复了受损的软骨,但进一步的基因鉴定表明,新生的软骨为猪的软骨而非人的软骨,这也从侧面证明了MSC的治疗作用可以通过旁分泌途径来实现,可以不依赖于细胞分化替代。亦有大量文献证明MSC来源的外泌体或条件培养基可以发挥类似MSC的治疗作用,文献很多,在此不做赘述。
其二:从药物代谢的角度来讲,移植的MSC不会在患者体内永远存活下去。在不同的研究中,MSC存在的时间和部位显示出明显的差异,它受到很多因素影响,包括供体受体因素、靶器官的趋向性、移植途径和机体免疫因素等。但无论自体来源还是异体来源的MSC,在移植后都终将被机体清除。然而,在很多临床治疗中发现,MSC发挥疗效的时间远比它在机体内的存活时间更长。在有些临床研究中,单次移植MSC后的疗效可以长至数月甚至1-2年(与疾病的种类和移植途径有很大关系)。

经肘静脉移植的MSC(111In-oxine标记)
在晚期肝硬化患者体内的分布[2]
我们认为出现这种情况的原因是MSC改善了靶器官中的疾病微环境,因此即使MSC被清除,微环境的改善仍可以使MSC的疗效维持很长一段时间。有一种简单的理解方式:常年贫瘠的土壤(微环境)被改善后,庄稼(细胞)容易存活,从而提高了庄稼产量(细胞功能)。这种对土壤的改善,目前普遍认为是通过MSC的外泌体来实现的,因为外泌体是细胞之间通讯的主要语言。

疾病微环境
综上,本文试着讨论了干细胞治疗的作用途径和外泌体治疗的可能性。然而究竟什么是外泌体?为何我们把外泌体治疗看做细胞治疗领域的下一个战场?外泌体治疗的机遇和挑战是什么?这些问题将在后续推文中展开探索,这次就先探讨到这里吧~~