发布时间:2024-12-10 浏览量:0

央视播出的《探秘衰老的秘密》节目。里面提到的一些关于干细胞的数据让我们意识到干细胞在生命进程中的关键意义。

“人在刚出生时,人体体细胞数有3万亿左右。其中干细胞约有60亿,这是一生中干细胞数量最多的时候,也是生长最快的时候。随着年龄的增长,干细胞数量开始下降。到25岁时,人体的体细胞数已经达到60万亿左右,而干细胞数量仅有约10亿,人体停止生长,开始逐渐衰老。到50岁时,体细胞数依旧是60万亿左右,但是干细胞数量仅剩下约3亿。人体衰老加速。各器官功能下降。”
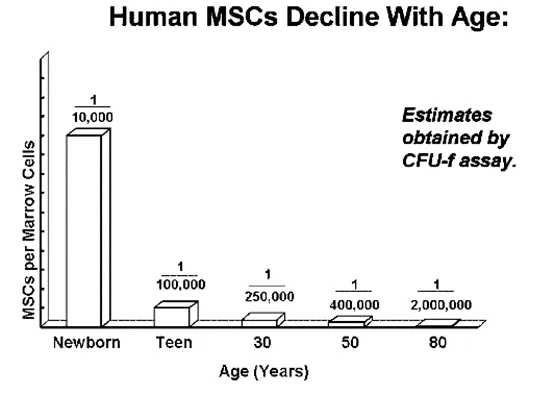
作为我们体内发挥着修复与再生作用的MSCs,在组织修复、免疫调节和抗炎反应中起着关键作用。随着年龄增长,我们的身体开始经历一系列变化:从皮肤弹性下降到关节僵硬,再到免疫力减弱,这与间充质干细胞(MSCs)功能的逐渐下降有着一定的关系。
干细胞随着年龄增长的变化
PART 01
近日,国际期刊《Current Stem Cell Research & Therapy》上的一篇综述讨论了MSCs衰老的详细机制和衰老后所引起的变化的最新研究进展。此外,文章还阐明了监测和逆转MSCs衰老的策略。

随着年龄增长,其数量的减少、质量的下降,会影响到我们的健康。研究表明,MSCs在衰老过程中会经历以下功能性衰退 :
1. 增殖能力下降
年轻时,MSCs能快速分裂、增殖,用于修复损伤。随着年龄增长,MSCs逐渐进入细胞衰老状态,分裂速度减慢,甚至停止繁殖。这导致组织再生能力下降,如骨质疏松和关节退化等疾病的发生。
2. 分化潜能减弱
MSCs的多能性会随年龄减弱,表现为骨细胞、软骨细胞分化能力下降,而脂肪细胞分化能力增加。这种变化导致:骨质流失风险增加(骨质疏松);软骨修复能力降低(关节炎风险增高)。
3. 免疫调节功能削弱
MSCs在调控免疫平衡中扮演“和平使者”的角色,防止过度免疫反应损害组织。但MSC功能衰退后,免疫系统容易失控,导致:炎症性疾病(如类风湿性关节炎、炎症性肠病);自身免疫疾病风险增加。
4. 抗氧化与抗炎能力减弱
MSCs能够清除体内过量的活性氧(ROS),保护细胞免受氧化应激。然而,老化的MSCs在氧化应激环境下容易受损,自身功能进一步下降。这种恶性循环会加速慢性炎症(“炎症性衰老”)、心血管疾病、神经退行性疾病等老年病的发生。
干细胞受年龄影响,也能提升机体年轻态
PART 02
尽管MSCs的功能会随年龄衰退,但科学家们正在探索多种方法来恢复其活力。早在1999年美国Science杂志将干细胞的研究成果列在十大科学进展之首,近年来干细胞在对抗衰老保持年轻态方面的研究更是吸引了全球的目光。随着相关的技术规范指南、专家共识或期刊文献的发表,人们对干细胞在抗衰老领域有了更深的认识。
2024年1月15日,国务院办公厅印发首个以“银发经济”命名的政策文件《关于发展银发经济增进老年人福祉的意见》首次提出发展抗衰老产业的方向。

其中“聚焦多样化需求,培育潜力产业”下的第十七条强调:发展抗衰老产业。深化皮肤衰老机理、人体老化模型、人体毛发健康等研究,加强基因技术、再生医学、激光射频等在抗衰老领域的研发应用。推动基因检测、分子诊断等生物技术与延缓老年病深度融合,开发老年病早期筛查产品和服务。推进化妆品原料研发、配方和生产工艺设计开发。
根据我国《老年医学与保健》杂志上发布的《中国衰老与抗衰老专家共识(2019年)》,成体干细胞的衰老乃至耗竭是组织器官衰老和老年性疾病的重要诱因。


世界卫生组织对疾病康复、抗衰老的新定义,也表达了对抗衰老的根本在于细胞:“治愈疾病、抗衰老最根本的途径是修复细胞、改善细胞代谢、激活衰老细胞的功能”。
许多折磨老年人的病理生理状况,如贫血、肌肉减少症和骨质疏松症,表明细胞损失和更新之间的不平衡。随着年龄的增长,组织的稳态维持和再生潜力减弱,这一事实暗示了干细胞在衰老过程中的核心作用。近年来,以干细胞为核心的在再生医学的发展,大大促进了人类探索抗衰老的步伐,为解决衰老相关疾病的临床困境提供了新思路。
未来展望
PART 03
虽然人类利用干细胞在对抗衰老保持年轻态方向仍需要进一步开展更大规模的研究,但是现阶段取得的一些向好的结果,让我们有理由相信以后人类放慢衰老的步伐将会有机会得以实现。随着人口老龄化加重医疗负担,我们也期待着干细胞在对抗衰老及衰老伴随的功能障碍领域将发挥更大的作用。


