发布时间:2024-11-29 浏览量:0

眼科疾病在全球范围内一直是致盲和视力障碍的重要原因,现有的治疗手段更多依赖于缓解病情和延缓视力丧失。近年来,干细胞外泌体一直不断的取得着创新突破,在眼部疾病方向的一些积极向好的研究成果也吸引着人们广泛的关注。
近日,一篇发表于国际权威期刊《Acta Ophthalmologica》的综述通过众多文献检索,表明外泌体,尤其是干细胞外泌体在眼部疾病方向的应用已经从实验室的初步探索逐步走向临床应用阶段,展现出巨大的潜力和前景[1]。

随着生物医学技术的进步,干细胞外泌体作为一种新兴的应对策略,正逐渐为应对眼科疾病带来突破。相比较MSCs而言,外泌体更加稳定,易于修饰,且不具有成瘤性的风险。此外,由于外泌体的纳米级尺寸和双层脂质膜结构,可以很容易地通过人体生物屏障进入靶向免疫器官和细胞发挥作用。
干细胞外泌应对眼部疾病的机制
PART 01
1.促进组织修复与再生
研究表明,外泌体可以促进角膜和视网膜等组织的修复,特别是在视网膜退行性变、角膜损伤等眼科疾病中,外泌体通过促进受损细胞的增殖和再生,显示出积极的治疗效果。
2.减少炎症反应
干细胞外泌体通过调节免疫系统,能够减少炎症反应。在眼科一些由免疫引起的疾病(如干眼症、角膜炎等)中,外泌体可显著减轻炎症症状,并促进局部免疫环境的恢复。
3.减少纤维化与疤痕形成
眼科手术(如角膜移植、白内障手术等)后常常会出现纤维化和疤痕形成,这不仅影响术后效果,还可能导致视力进一步下降。干细胞外泌体能够通过抑制成纤维细胞的活性,减少纤维化和疤痕形成,从而促进更为理想的愈合过程。
4.靶向递送
干细胞外泌体具备较高的靶向性,能够精准地将治疗分子送至病变部位。结合基因编辑技术和纳米技术,外泌体的靶向递送系统能够进一步提高疗效,减少副作用。研究表明,干细胞外泌体能够靶向作用于视网膜的微血管,显著减轻血管渗漏,促进视网膜的血流恢复[2-3]。
应对眼部疾病,潜力十足
PART 02
现有的一些研究表明,外泌体对眼部疾病具有一定的治疗潜能。
干眼症
哥本哈根大学的Michael Møller-Hansen教授团队进行了一项创新的临床研究,通过向泪腺注射间充质干细胞外泌体来改善泪腺的分泌功能,从而缓解干眼症状。这项研究的结果发表在《The Ocular Surface》杂志上,为干眼症的治疗开辟了新的途径。
研究结果显示,在平均126天的随访期内,所有受试者均未出现治疗相关的不良反应。治疗眼的眼表疾病评分、泪液渗透压显著降低,泪膜破裂时间显著延长,Schirmer’s I 5min结果显著改善,角膜染色评分也呈现下降趋势。研究证明,间充质干细胞及其衍生的外泌体在干眼症的治疗中展现出巨大的潜力。
青光眼
青光眼是一种视神经退行性疾病,是不可逆失明的主要原因,通常与眼内压升高有关。高眼压导致视网膜神经节细胞(RGCs)的丧失,从而引起失明。因此,如何缓解RGCs的损害是青光眼失明预防和治疗的重点。
最近的一项研究[4]利用间充质干细胞衍生的外泌体治疗青光眼大鼠模型。结果表明,每周和每月玻璃体内注射间充质干细胞衍生的外泌体促进了RGCs的神经保护作用。
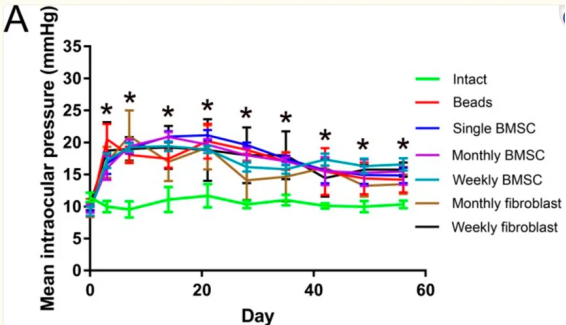
葡萄膜炎
葡萄膜炎是由虹膜、睫状体、玻璃体、视网膜或脉络膜的炎症引起的疾病。治疗的及时性很重要,否则它可能导致不可逆的视力丧失。
在一项研究中[5],研究人员使用了被诱导患有自身免疫性葡萄膜视网膜炎的大鼠模型。在使用人间充质干细胞外泌体后显示出抑制自身免疫反应,通过减少T细胞亚群和其他炎症细胞在眼中的浸润。
此外,CCL2和CCL21对炎症细胞的化学吸引作用被间充质干细胞外泌体抑制,从而保护视网膜结构并挽救视网膜功能。
结果表明,间充质干细胞外泌体通过抑制炎症细胞的迁移有效地改善了葡萄膜炎,表明间充质干细胞外泌体对葡萄膜炎有望成为潜在的新疗法。
未来展望
PART 03
外泌体作为细胞分泌的天然纳米级囊泡,被认为是免疫反应最小的药物递送载体。外泌体在各种生物过程中的重要作用,影响各种生理和病理过程,已从分子机制证明外泌体参与眼病的发病机制、诊断和治疗。
虽然目前干细胞外泌体在应对眼部疾病方向仍处于临床研究阶段,但通过不断的技术进步和临床验证,干细胞外泌体有望为眼科疾病治疗带来革命性的突破,有利于实现未来眼部疾病的精准医疗。我们期待,该项技术可以早日成熟,为受到眼部疾病困扰的朋友带来新的希望!
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


