发布时间:2024-11-05 浏览量:0

2013年,细胞外囊泡的发现获得诺贝尔生理学或医学奖。2024年,miRNA及其转录后基因调控中的作用的发现获得了诺贝尔生理或医学奖。

外泌体是细胞分泌的非常小的囊泡,干细胞作为人体身体中一种非常特殊的细胞,它有两个重要的能力,一个是自我更新,就是它可以不断地复制自己;另一个是自我修复,当身体某个部位受伤时,它可以帮助修复受损的组织。而细胞之间也有“邮件系统”,外泌体就像细胞之间传递信息的“小包裹”,它们携带着重要的生物“信件”,比如蛋白质、RNA、脂质等,帮助细胞相互沟通[5]。
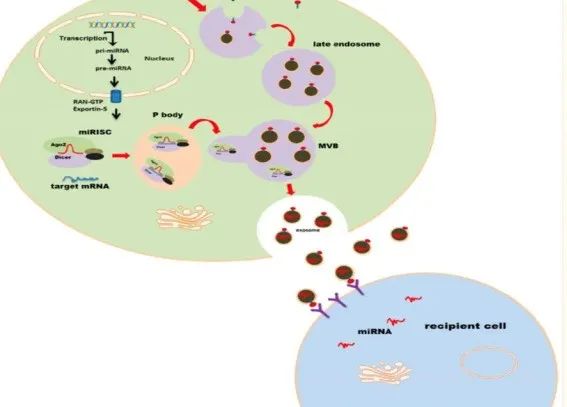
图 | 图源文献[2]
人体皮肤是人体最大的器官,是抵御环境因素,尤其是紫外线(UV)辐射的主要屏障。
紫外线根据波长分为UVA(320–400纳米)、UVB(280–20纳米)和UVC(280–100纳米)。UVC被平流层臭氧层吸收,无法到达地球。相对于UVA,UVB对皮肤的穿透力较弱,但伤害更大。暴露于UVB会增加各种皮肤病的风险,导致晒黑和炎症反应,包括短期内发红和起泡。从长远来看,它会导致光老化,包括皱纹、屏障能力和弹性下降,以及增加致癌风险。
178项研究证实外泌体预防疤痕和光损伤,对抗衰老及色斑
PART 01
据最新发布的文献[6],研究人员以“外泌体”及皮肤“为关键词”对2010-2023年期间的PubMed文献进行了全面搜索,对符合条件的178项研究进行了汇总分析,表明了其在皮肤问题等方向的潜在前景。
10月30日,北京协和医学院的研究团队在行业期刊signal transduction and targeted therapy上在线发表了题为Human adipose and umbilical cord mesenchymal stem cell-derived extracellular vesicles mitigate photoaging via TIMP1/Notch1的研究报告,证明了间充质干细胞来源的细胞外囊泡通过TIMP1/Notch1减轻光老化。

此外,该研究团队还通过 EV 蛋白质组学和 RNA 测序研究了潜在的分子机制。具体来说,研究人员确定了 MSC-EV 货物中的关键蛋白质成分 TIMP1,它主要介导 MSC-EV 的抗光老化作用。
该研究结果强调了细胞外囊泡通过抗炎作用、皮肤基质重塑和抗衰老特性的应对作用。从机制上讲,蛋白质组学分析表明 TIMP1 在 细胞外囊泡高度表达,并发挥与 MSC-EV 类似的作用。TIMP1 在介导 MSC-EV 的发挥作用中起着关键作用,TIMP1 有助于减轻细胞衰老、DNA 损伤、氧化应激和 皮肤基质水解,随后下调 Notch 表达。
案例分享
国际上一些相关的临床研究也是展现了外泌体的潜力。《美容皮肤病学杂志》上发表的双盲、随机、对照研究提供了更多的数据。

研究人员随机选择了21名女性志愿者【30~40岁2名,40~50岁11名,50岁以上8名】分为安慰剂组(不含ASC-外泌体)和实验组(含ASC-外泌体),开展为期8周的研究。在研究前和研究后2、4和8周使用Mexameter测量黑色素水平。
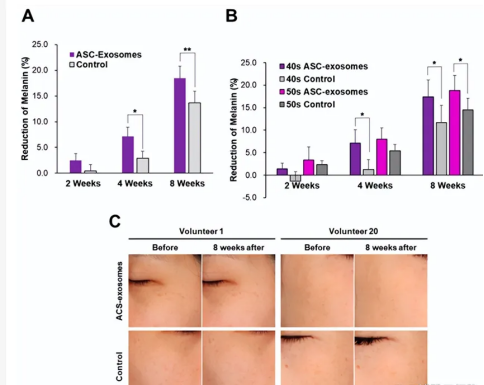
结果显示,与安慰剂组相比,实验组的黑色素水平在研究开始后2周开始降低;4周后两组数据有了显著性的差异,8周后两组有一定显著性差异,皱纹指数、黑色素指数、患者满意度评分和整体审美改善量表均显著高于使用对照组。
未来展望
PART 02
对于提升年轻态方向,越来越多的文献证明了外泌体具有一定的潜力。例如,通过使用来自人类真皮成纤维细胞(HDFs)的外泌体,可以观察到增加的胶原蛋白产生以及真皮基质的增厚[6]。
应对光损伤方向,外泌体也有着令人惊喜的表现,如来自人脐带间充质干细胞的外泌体(hucMSC-ex)能够通过减少组织内的活性氧(ROS)产生和炎症来减轻紫外线诱导的光损伤皮肤[6]。
疤痕修护方向,一项发表在《STEM CELLS》杂志上的关于外泌体的研究,证明了外泌体和受到外泌体影响的巨噬细胞可以促进韧带愈合并减少疤痕。

对于面部斑点问题,也有相关文献表明[8],干细胞外泌体通过改变基因表达和多种酶活性来调节黑色素细胞的色素合成,减少皮肤的氧化应激损伤,抑制酪氨酸酶活性。
近年来,干细胞外泌体在多个领域都展现了其潜力。随着研究的不断深入,我们也相信它可以为我们带来更多的惊喜,真正意义上的造福更多需要的人。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


