发布时间:2024-09-05 浏览量:0

急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome, ARDS)是临床上常见的一种急危重综合征,临床特征为难以纠正的低氧血症和进行性加重的呼吸窘迫。24~48小时发病,也可长至5~7天。主要表现为:呼吸急促、口唇及指(趾)端发绀、极度缺氧的表现,可伴有胸闷、咳嗽、血痰等症状。病情危重者可出现意识障碍,甚至死亡等。

△ARDS判定标准
关于ARDS及其现有治疗方式
PART 01
ARDS的疾病发展进程可分为3个阶段:急性/早期或渗出期、组织期或增殖期、晚期缓解期或纤维化期。导致ARDS出现的病因十分复杂,目前已确定的风险因素主要有肺内原因和肺外原因,其中肺内原因主要有肺炎、误吸、肺挫伤、淹溺、有毒气体等;肺外原因主要有全身严重感染、严重多发伤、休克、高危手术、大量输血[1]、药物中毒、胰腺炎等。
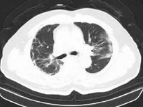
正常肺
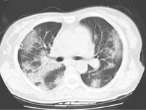
ARDS患者肺
2016年,一项针对50个国家459个重症监护病房(ICU)患者的研究报告称,10%的ICU患者和23%的机械通气患者符合急性呼吸窘迫综合征的标准,整体死亡率高达35-45%。一项针对中度至重度ARDS的大型试验报告称,90天时院内死亡率为43%[7]。
尽管大多数急性呼吸窘迫综合征幸存者恢复了正常或接近正常的肺功能,但许多人仍然受到与肌肉无力、认知障碍、抑郁和神经肌肉无力等并发症,将遭受长期的生活质量下降问题。
ARDS发病机制尚未十分明确,其发病机制涉及较多方面,主要包括炎症失调、肺泡上皮细胞损伤、肺毛细血管内皮细胞损伤、微循环障碍和细胞凋亡等过程。
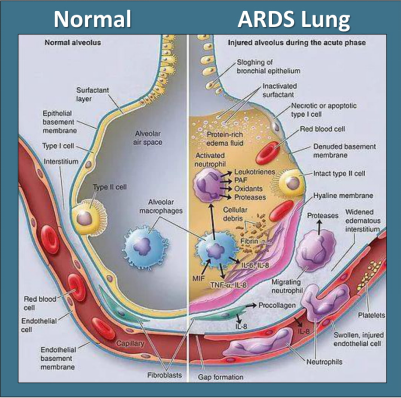
ARDS常规针对策略主要有原发病治疗、呼吸支持治疗(包括无创正压通气、肺保护性通气、呼气末正压、肺复张、俯卧位通气、高频震荡通气、体外膜肺氧合)、药物治疗(包括抗炎治疗、抗凝及纤溶激活治疗、抗氧化治疗、外源性肺表面活性物质(PS)替代治疗),到目前为止,还没有批准的药物治疗这种综合征,也几乎没有药物可以降低ARDS的发病率和死亡率。
干细胞或成为针对ARDS新策略
PART 02
尽管ARDS的临床表现明确,但针对它的手段有限,病死率居高不下。
国内一科研团队发表文章《间充质干细胞调控免疫细胞治疗急性呼吸窘迫综合征的研究进展》,揭示了间充质干细胞(MSCs)在调控免疫细胞中所起的关键作用,为ARDS的临床应用研究提供了崭新视角[12]。

MSCs与免疫调节机制
MSCs通过调控固有免疫和适应性免疫反应,在针对ARDS过程中发挥核心作用。在固有免疫系统中,MSCs能够影响巨噬细胞的极化状态,促使M1型(促炎)巨噬细胞向M2型(抗炎)极化,进而减轻炎症反应。MSCs通过细胞外囊泡(EVs)传递特定的miRNA,如miR-17和miR-27a-3p,调节巨噬细胞功能,抑制炎症并促进M2极化,有利于肺损伤的恢复。此外,MSCs还能调节树突状细胞(DCs),促进其向产生耐受性的DCreg转化,抑制淋巴细胞活性,减少炎症因子的释放。
在适应性免疫方面,MSCs通过影响T淋巴细胞的增殖和分化,特别是调节Th17/Treg细胞平衡,减轻肺部炎症。Th17细胞过度激活是ARDS发病机制的一部分,而Tregs则具有免疫抑制作用,维持两者平衡对治疗至关重要。MSCs及其EVs可通过携带miRNAs等分子,如miR-10a和miR-21,促进Treg分化,抑制Th17细胞介导的炎症反应。
临床应用与挑战
在临床应用方面,MSCs已显示对COVID-19引起的ARDS具有积极效果,通过改善肺功能和总体预后。单次静脉注射MSC-EVs能有效降低缺氧、调节免疫反应和减少细胞因子风暴,且安全性良好。然而,MSC的针对性效果受多种因素影响,包括细胞来源、分化状态、给药方式等。未来,通过基因修饰、预处理MSCs,或结合其他药物使用,可以进一步提升其潜力。
未来展望
PART 03
MSCs及其EVs在调控免疫细胞功能、减轻ARDS炎症反应和促进肺组织修复中展现出巨大潜力。虽然已有初步临床应用成果,但深入理解MSCs与免疫细胞间复杂的相互作用机制,以及优化相应的临床应用方案,仍是未来研究的重点。随着技术的进步和机制探索的深入,MSCs及其衍生产品有望成为针对ARDS及其他炎症性肺病的重要工具,为患者带来新的选择。
截止2023年12月,国家卫健委备案合计通过127项干细胞研究备案项目,其中92项为间充质干细胞,68项为脐带来源的间充质干细胞。因此,间充质干细胞有望成为ARDS患者的福音。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


