发布时间:2024-08-06 浏览量:0

近年来,过继细胞疗法(ACTs),特别是嵌合抗原受体T细胞(CAR-T)疗法,已被证明是最有前途的癌症免疫治疗策略之一。迄今为止,全球已获批上市的CAR-T产品共计11款,CAR-T疗法可以显著改善患者的预后,在血液系统恶性肿瘤的治疗中显示出强有力的疗效。
然而,CAR-T疗法在治疗实体瘤方面仍面临着重大挑战。这主要是由于实体瘤的免疫抑制肿瘤微环境( TME)、肿瘤部位的细胞外基质(ECM)难以浸润、缺乏肿瘤特异性抗原、抗原逃逸等。而靶向实体肿瘤的CAR-巨噬细胞是克服这些障碍的潜在候选者,在许多癌症中,巨噬细胞占肿瘤浸润免疫细胞的大多数,且具有更丰富的抗肿瘤机制和更好的肿瘤浸润持久性。因此,CAR-巨噬细胞在治疗实体肿瘤方面具有令人鼓舞的潜在优势。
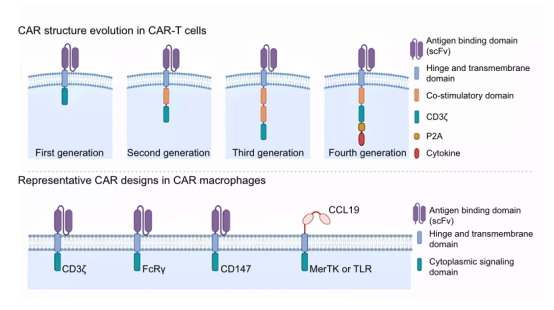
CAR-T细胞和CAR-巨噬细胞的CAR结构
PART 01
CAR-T细胞中的CAR结构
CAR- T细胞中使用的常规CAR包括四个结构域:抗原结合结构域、铰链区、跨膜结构域和一个或多个细胞质信号传导结构域(图1)。目前,在CAR-T研究和临床试验中,第二代CAR是最普遍的选择。此外,CAR设计的进步催生了第三代、第四代和其他创新结构,如Split CARs、iCARs和SynNotch CARs。这些设计旨在提高抗肿瘤疗效以及减轻严重的副作用。
CAR-巨噬细胞中的CAR结构
CAR-巨噬细胞中使用的CAR结构包括抗原结合域、铰链区、跨膜域和细胞质信号域(图1)。CAR-M常用的胞内信号传导结构域主要为CD3、CD147、Megf10和FcR。CAR-巨噬细胞特有的信号域可以赋予CAR-巨噬细胞一些独特的抗肿瘤机制。最具代表性的是来自CD147的激活域,这个信号域不是触发吞噬,而是上调基质金属蛋白酶(MMPs)的表达和分泌。MMPs可以降解实体瘤周围致密的ECM,促进免疫细胞浸润到肿瘤部位。
CAR-T细胞和CAR-巨噬细胞的对抗肿瘤机制
PART 02
CAR-T细胞的抗肿瘤机制包括:穿孔素颗粒酶途径、死亡受体途径和细胞因子分泌。CAR-T细胞识别肿瘤抗原后,通过穿孔素-颗粒酶途径(细胞凋亡的内在途径)或死亡受体途径(细胞凋亡的外在途径)诱导肿瘤细胞的细胞毒性。凋亡的肿瘤细胞释放新的肿瘤抗原,这些抗原随后被抗原呈递细胞(APCs)吞噬,然后APC将这些新的抗原呈递给内源性T细胞。CAR-T细胞还与其他免疫细胞和肿瘤基质相互作用,通过分泌细胞因子介导肿瘤杀伤。
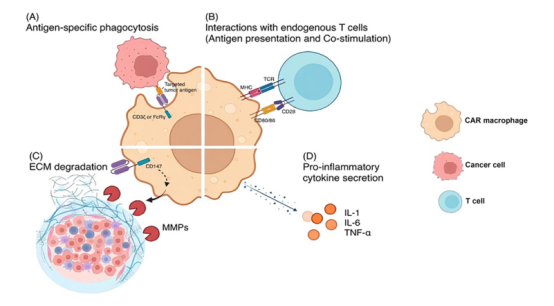
图2 | CAR -巨噬细胞治疗的抗肿瘤机制
1) CAR -巨噬细胞通过嵌合抗原受体介导的抗原特异性吞噬作用直接杀伤肿瘤细胞;
2) CAR -巨噬细胞与内源性T细胞表现相互作用。一方面,它们将被吞噬的肿瘤抗原呈递给T细胞,另一方面,CAR -巨噬细胞可能通过共刺激促进内源性T细胞的活化和持久性;
3) CAR -巨噬细胞以CD147作为信号域时,可分泌基质金属蛋白酶(MMPs),降解实体瘤周围致密的细胞外基质,从而促进其他免疫细胞的浸润, 这种新机制为癌症免疫治疗提供了一种有希望的策略;
4) CAR -巨噬细胞表现出m1样表型,使它们能够分泌促炎细胞因子(如IL-1、IL-6和TNF-α)来调控肿瘤微环境。
CAR -巨噬细胞治疗实体瘤的主要优势在于其不同的抗肿瘤机制,包括与其他免疫细胞的广泛相互作用(通过分泌各种促炎细胞因子或作为APC),有效地重新激活TME的能力,促进T细胞浸润持续性的能力。
实体瘤临床面临的挑战
PART 03
1) 缺乏合适的肿瘤抗原
CAR-T和CAR -巨噬细胞疗法共同面临的一个重大障碍是缺乏合适的TSA或TAAs。而合适的TSAs或TAAs的鉴定仍是一个亟待解决的难题。特别是靶外肿瘤毒性、抗原逃逸现象和肿瘤内抗原异质性。
2) CAR-T细胞浸润不足和非持续性
CAR-T靶向实体肿瘤的另一个重要障碍是CAR-T细胞对肿瘤部位的浸润不足且不持久,致密的ECM经常阻碍CAR-T细胞的浸润。
CAR-T和CAR -巨噬细胞针对实体瘤的临床试验
PART 04
迄今为止,全球已有超过200项注册临床试验研究CAR-T细胞治疗实体瘤,其中大多数是旨在评估不同CAR-T产品安全性和有效性的I期试验。胶质瘤、胰腺癌、肺癌、乳腺癌和前列腺癌是最常用于评估的肿瘤类型。最常见的靶向抗原是人表皮生长因子受体2 (HER2)、间皮素和cludin18.2,其中4-1BB是最常用的共刺激结构域。
与CAR-T相比,CAR -巨噬细胞治疗的临床经验和可用数据有限,仍处于起步阶段。截至目前,仅有4项CAR-M相关研究在Clinicaltrials.gov上注册 (NCT04660929 , NCT04405778,NCT05007379, NCT06224738)。CAR -巨噬细胞治疗实体瘤的第一个I期临床试验(NCT04660929 CT-0508),主要用来针对复发/难治性HER2过表达的肿瘤患者,2021年3月20日Carisma团队宣布已完成CT-0508的1期临床研究首例受试者给药,这是首个进入临床的CAR-M疗法,同时也意味着正式开启了CAR-M的新篇章。
截止目前, CT-0508的研究结果表明:接受CT-0508临床试验的14名受试者中,有4名受试者(28.6%)疾病获得稳定。这4名受试者均为HER2 3+患者。所有HER2 2+患者疾病均进展。试验中报告的大多数不良事件为1-2级,没有报告剂量限制性毒性,也没有严重(3-4级)细胞因子释放综合征(CRS)或任何级别免疫效应细胞相关神经毒性综合征(ICANS)的病例。靶向HER2的CAR-M细胞疗法CT-0508在患有各种实体瘤的患者中显示出可耐受的安全性和抗肿瘤活性的迹象。CT-0508试验的研究结果一定程度上支持了CAR-M疗法的安全性、可行性和作用机制,但由于研究的匮乏,CAR-M疗法仍迫切的需要更多的临床数据来证实CAR-M治疗的可行性。
未来展望
PART 05
CAR-T和CAR-巨噬细胞疗法仍然面临一定的局限性,例如缺乏有效和安全的TSA或TAAs以及治疗相关的不良事件,如靶外肿瘤(OTOT)毒性。通过下一代测序技术对肿瘤和正常RNA进行比较分析,同时采用免疫肽组学方法和基于T细胞的检测,为鉴定实体肿瘤中新的靶向抗原提供了有希望的途径。通过这些新兴的方法,可以识别被称为新抗原的肿瘤抗原。对于CAR-巨噬细胞的治疗,确定新的靶向抗原是减轻OTOT毒性的基本和有效的方法。针对肿瘤部位微环境的新型免疫治疗剂也正在彻底改变癌症治疗。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


