发布时间:2024-06-20 浏览量:0

在接受靶向CD19的嵌合抗原受体(CAR)T细胞免疫治疗的患者中,超过一半的患者没有获得持久的缓解, PD-1/PD-L1相关的CAR-T细胞功能障碍是可能的部分原因。
PD-1是一种膜受体蛋白,主要存在于免疫细胞表面,如T细胞和B细胞等。通过调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。PD-L1是PD-1的配体蛋白,是大小为40KDa的第一型跨膜蛋白。主要存在于免疫细胞和某些非免疫细胞表面。PD-1可与PD-L1结合,通过PD-1/PD-L1通路降低CD8+T淋巴细胞及 CD4+T淋巴细胞活性,并抑制二者增殖,进而抑制肿瘤局部微环境中T淋巴细胞发挥作用,对肿瘤的免疫杀伤功能降低,肿瘤易发生免疫逃逸。在对CD19CAR-T细胞免疫治疗未能获得持久应答的患者的预处理肿瘤活检标本中观察到PD-L1的高表达。[1]这些数据表明,中断PD1/ PD-L1轴可能会提高CAR-T细胞治疗的成功率。
利伯蒂·巴普蒂斯特学院的一项小型1期临床试验报告了CD19CAR-T细胞治疗后LBCL进展的患者对抗PD1单克隆抗体治疗的反应。[2]然而,CD19CAR-T细胞联合免疫检查点封锁(ICB)免疫治疗的研究数据令人失望。[3]CD19CAR-T细胞联合ICB治疗失败的原因尚不清楚。此外,这些研究并没有能力解决联合治疗方案的差异。
有研究表明,PD-L1抑制剂优于PD-1抑制剂,因为严重不良事件(AEs)的风险较低,特别是免疫相关的AEs。[4]
2024年Alexandre V. Hirayama[5]等报告了一项1期临床试验( NCT02706405) 的 数 据 ,该成人大B细胞淋巴瘤(LBCL)患者使用自体CD19CAR-T细 胞联合剂量不断增加的抗PD-L1单克隆抗体durvalu单 抗治疗。
患者分成2组,如图1所示,1组患者最初在CD19CAR-T后21天内 开始接受第一剂量的durvalu单抗。在安全性分析后,随后的患者在CD19CAR-T后7天开始接受durvalu单抗治疗。2组患者在CD19CAR-T给药前 1天首次给予durvalu单抗。第1组和第2组首次输注durvalu单抗的剂量水平列于表1。对于两组,在注射CD19CAR-T输注后,以确定的最高安全剂量给予至多10个周期,直到不可接受的毒性或疾病进展 。
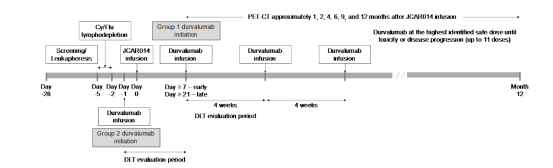
图1:治疗方案。Cy,环磷酰胺;DLT,剂量限制毒性;Flu,氟达拉滨。
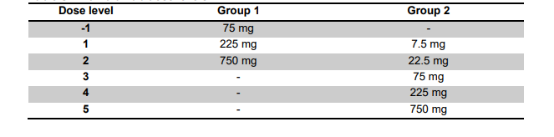
表1 durvalu单抗的剂量水平
我们对ICB与CD19CAR-T的联合使用的安全性进行了评估。结果显示,≥1级和≥3CRS和神经毒性的发生率与之前的经验一致,2个治疗组之间相似(表2)。然而,与组1相比,组2患者在CAR-t细胞输注后CRS发病较晚(中位数6vs4天;P =.05),CRS持续时间较短(中位数3 vs 8天;P =.08;表2 )。
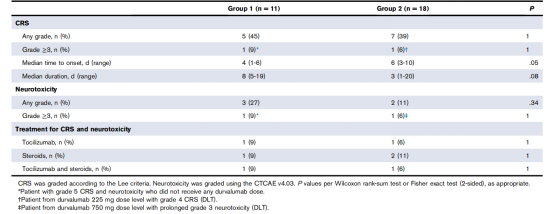
表2 CRS反应和神经毒性
LBCL患者接受相同的Cy/Flu淋巴清除术和相同的CAR-T细胞回输剂量(2×10^6/kg)。与单独使用CAR-T细胞治疗的患者相比,CAR-T细胞联合durvalu单抗治疗的患者ORR(P = .08)和CR率(P = .09)有较低的趋势(表3)。尽管肿瘤负荷较低,但第2组患者(CAR-T细胞前首次使用durvalumab)的CR率及ORR率均低于第1组治疗患者(CAR-T细胞后首次使用durvalu单抗;P=。16)。1组患者(CAR-T细胞后首次使用durvalumab)与单独接受CD19CAR-T 组患者的ORR和CR率无显著差异。这些数据表明,在CAR-T细胞回输之前应用durvalumab单抗患者整体疗效较差。
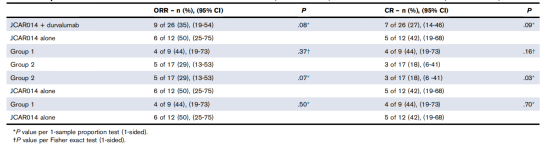
表3 ICB与CD19CAR-T的联合使用的有效率
长期随访结果显示,接受CD19CAR-T和单抗药物的患者DOR优于单独接受CD19CAR-T(1年DOR估计,67%;95% CI,42-100vsDOR,20%;95% CI,3-100;图2)。我们认为,尽管有一部分患者最初的反应较差,但随后每月注射durvalumab可能有助于改善CD19CAR-T后的DOR。
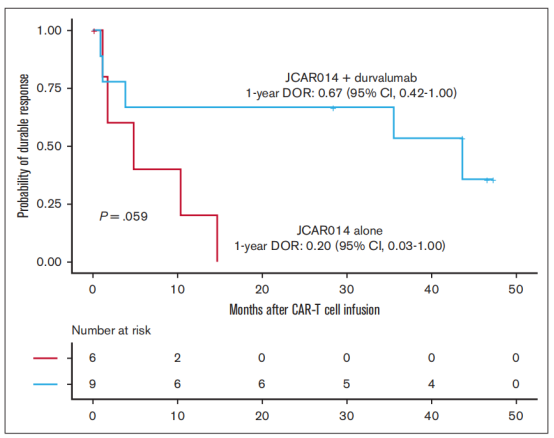
CD19CAR-T + durvalumab或者CD19CAR-T 单独治疗后患者DOR。持续缓解时间(DOR)
总之,PD-L1阻断的应用时间是影响成人LBCL接受CD19CAR-T细胞免疫治疗后预后的一个关键变量。对于PD-L1单抗和CD19CAR-T联合应用的探索是目前临床研究的热点之一。
【注】文章内容旨在科普细胞知识,进行学术交流分享,了解行业前沿发展动态,不构成任何应用建议。


